|
|


바이로메드는 지난 8월 9일~10일 양일간 미국 시카고에서 당뇨병성 족부궤양 임상3상 시험의 본격 진행을 위해 임상연구자 회의(Investigator Meeting)를 개최했다고 전했다.
이번 임상시험의 첫번째 약물투여는 작년 8월에 Miami Dade Medical Research Institute에서 실시됐으며, 지금은 노스웨스턴 의과 대학, 텍사스 심장 연구 센터, 아리조나 의과대학, 세인트 루이스 대학 등 미국 내 23개 병원에서 환자모집 중이다.
현재 8월 9일 기준 22명의 환자들에게 약물이 투여됐다. 당뇨병성 족부궤양 분야에서 유전자치료제 투여는 세계적으로도 처음있는 일이라 효율적인 진행을 위해 참여하는 의사들의 교육과 이해가 필요했다고 회사 측은 설명했다.
이번 시카고에서 개최한 연구자 회의에서는 혈관외과(Vascular Surgeon)와 족부(Doctor of Podiatric Medicine) 전문의 등 의사 18명, 연구 간호사 및 코디네이터 29명, CRO 등 총 74명이 참여했다. 이 미팅에서는 VM202 약물의 작용 원리, 임상3상 효율적 진행 방안 등 다양한 주제들에 대해 활발한 논의가 이뤄졌다.
이번 임상3상의 총 책임자인 Texas Heart Institute Center for Clinical Research의 Dr. Emerson Perin은 "중증하지허혈(CLI)을 대상으로 했던 임상1상과 2상 연구를 통해 VM202의 안전성과 유효성을 확인했다. 중증상태인 CLI 임상시험에서 높은 비율로 궤양이 치료되는 우수한 결과들로 미루어볼 때 당뇨병성 족부궤양에서는 더 좋은 결과가 예상 된다"며 기대감을 전했다.
바이로메드의 Clinical Director인 Dr. Marie Nevoret는 이번 임상시험에서 측정될 주요 지표들에 대한 검사 방법과 그 중요성, 약물 투여시 주의 사항들에 대해 발표하면서 족부궤양 관련 FDA 가이드라인을 설명했다.
[당뇨병성 족부궤양 VM202 임상3상 주요 프로토콜]
대상질환: 허혈성 당뇨병성 만성 족부궤양 (Chronic Diabetic Foot Ulcers With Peripheral Arterial Disease (PAD))
임상시험 규모: 총 300명
임상계획: 위약대조, 이중맹검, 다기관, 무작위배정
약물투여 계획: 2주 간격 4회(Day 0, 14, 28, 42) 총 16mg 투여
유효성 평가 항목
- 1차 지표: 시험약 투여 후 4개월 째 궤양 완치된 환자들의 비율
- 2차 지표: 궤양이 완전히 치유되기까지 소요시간, 궤양크기의 변화율, 새로운 궤양의 형성 등
안전성 평가
김선영 바이로메드 대표는 "첫번째 임상3상 대상이었던 당뇨병성 신경병증에 대한 임상시험은 환자 모집이 종료되었는 바 허혈성 당뇨병성 만성 족부궤양을 빠르고 효율적으로 추진하기 위해 이 미팅을 개최했다. 당뇨병성 족부궤양에는 유전자치료제가 시도된 전례가 없기 때문에, 이번 미팅을 통해 의료진들의 이해를 돕고 상호 의견을 나누고자 했다. 이번 미팅을 통해 임상시험을 빠른 시일 내에 완성할수 있는 기반을 마련했다"고 언급했다.
| 바이로메드 주담 통화 내용 (0) | 2018.08.18 |
|---|---|
| 난치병 치료 유전자치료제 미래신약 주목…국내 임상만 67건 (0) | 2018.08.15 |
| 바이로메드, 샌디에고 생산시설의 풀가동을 위해 전문가들 본격 영입 (0) | 2018.08.14 |
| 바이로메드, HGF유전자의 신경재생 원리를 밝혀 국제학술지 게재 VM202의 disease modifying 능력을 입증 (0) | 2018.08.13 |
| 바이로메드 "VM202 'HGF유전자' 신경재생 원리 규명" (0) | 2018.08.11 |
바이로메드(대표이사: 김선영, 084990:KS)가 플라스미드 DNA 생산을 위해 인수하고 설립한 미국법인 제노피스(GENOPIS, Inc.)의 핵심 운영 인력과 기술자들을 영입하여 공장 가동에 들어간다.
운영최고책임자 (Chief Operating Officer)는 미국의 유전자치료 기업인 바이칼(Vical)에서 부사장으로 근무하던 Keith Hall이다. Keith Hall은 UC-산타바바라에서 미생물학을 전공하고 휴스턴대학(University of Houston)의 CT 바우어 경영대학에서 MBA을 이수했고 Amgen, Gyritech, Valentis/GeneMedicine, Agennix, Vical 등의 회사에서 28년 경험을 쌓은 바이오의약품 생산, FDA CMC 규정 전문가이다.
Keith Hall은 “시장성과 성공 가능성이 높은 VM202 생산에 참여를 원하는 지원자가 많아 경험이 풍부한 전문가들로 빠르게 팀을 구성할 수 있었다.”고 전했다. 또한, “제노피스의 생산시설은 이전 바이칼(Vical)의 DNA 임상 3상 시료를 만들었는바, 미국 FDA로부터 대량생산 허가를 받을 준비가 완료된 곳이다.”라고 말했다.
제노피스 생산시설에서 DNA 생산은 Bayer, Novartis, Baxter Bioscience의 회사들을 거치면서 25년 간 다양한 바이오의약품들을 대량 생산한 경험을 가진 Robert Catalos가 맡게 된다. 생산된 제품들의 품질관리는 Tanvex, Vical 등 기업에서 20년간의 품질관리 경험이 있는 전문가인 Jeff Learn이 맡을 예정이다.
제노피스의 설립을 주도했던 바이로메드 전력총괄실의 나한익 실장은 “디렉터 급 인력의 영입이 완료되었고, 이제 기술자와 테크니션들에 대한 모집에 들어갔다. 지역 특성 때문인지 동일 포지션에 수십 명의 우수 후보자들의 지원서를 내서 놀랬다. QC, Engineer, 공정개발, 생산, 지원 등 GMP 생산에 필요한 인력을 충원할 예정인데 수개월 내에 25명 정도 될 것이다. 이미 발표한 바와 같이 2019년 상반기 내 GMP 생산을 목표로 업무가 본격 적으로 진행될 것이다.”고 전했다.
그간 임상시험에 사용되었던 시료와는 다른 곳, 즉 제노피스에서 생산하는 것이기 때문에 동등성 비교시험이 필요한데, 특별히 어려운 점이 있느냐는 질문에 대해서 대표이사인 김선영박사는 간단히 “전혀 없다”고 말하며 “그간 만난 도전과 어려움에 비하면 동등성 시험은 비교적 단순한 과정”이라고 밝히면서 “언젠가 밝히겠지만, 제노피스는 빠른 시일 안에 이익을 내는 기업이 될 것이다.”라며 운영에 자신감을 피력했다.
※ 관련기사 |
| 난치병 치료 유전자치료제 미래신약 주목…국내 임상만 67건 (0) | 2018.08.15 |
|---|---|
| 바이로메드, 당뇨병성 족부궤양 임상3상 연구자 회의 (0) | 2018.08.15 |
| 바이로메드, HGF유전자의 신경재생 원리를 밝혀 국제학술지 게재 VM202의 disease modifying 능력을 입증 (0) | 2018.08.13 |
| 바이로메드 "VM202 'HGF유전자' 신경재생 원리 규명" (0) | 2018.08.11 |
| 합병증이 더 무서운 당뇨병… ‘신경병증’ 주의를 [출처]합병증이 더 무서운 당뇨병… ‘신경병증’ 주의를-서울대학교 의과대학 국민건강지식센터 (0) | 2018.08.09 |
바이로메드, HGF유전자의 신경재생 원리를 밝혀 국제학술지 게재
VM202의 disease modifying 능력을 입증
혁신 바이오신약 개발 기업 바이로메드(084990:KS)는 HGF(간세포성장인자)가 어떻게 슈반세포의 활성에 관여하는지, 그 경로와 원리를 규명하여 VM202의 작용기전(MOA) 중의 하나를 밝혔다고 전했다.
■ 배경:
■ 연구 결과:
■ 대표이사 김선영 박사는 “이번 연구를 통해 HGF가 슈반세포에서 c-Fos를 증가시켜 손상된 신경을 복구시킬 수 있다는 것을 처음으로 밝혔다. 특히 VM202가 어떻게 망가진 신경을 고치고, 장기간 진통 효과를 내는지를 이해하는데 도움이 되었다. 이번 발견은 VM202가 슈반세포에 작용하여 여러 종류의 신경질환에 사용될 수 있다는 것을 의미하는 것으로서, VM202의 확장성이 매우 클 수 있음을 시사하는 것이다.”고 말했다. |
| 바이로메드, 당뇨병성 족부궤양 임상3상 연구자 회의 (0) | 2018.08.15 |
|---|---|
| 바이로메드, 샌디에고 생산시설의 풀가동을 위해 전문가들 본격 영입 (0) | 2018.08.14 |
| 바이로메드 "VM202 'HGF유전자' 신경재생 원리 규명" (0) | 2018.08.11 |
| 합병증이 더 무서운 당뇨병… ‘신경병증’ 주의를 [출처]합병증이 더 무서운 당뇨병… ‘신경병증’ 주의를-서울대학교 의과대학 국민건강지식센터 (0) | 2018.08.09 |
| 까다로운 'FDA 승인' 잇단 도전… K바이오 '美 상륙작전' 속도 낸다 (0) | 2018.08.09 |
http://biospectator.com/view/news_view.php?varAtcId=5996
바이로메드가 11일 개발중인 유전자치료제 VM202의 작용기전(MOA)에 관한 또다른 연구결과를 내놨다. 이번에는 VM202에 핵심성분인 간세포성장인자(HGF) 유전자가 어떻게 슈반세포의 활성에 관여하는지, 그 경로와 원리를 규명했다.
이번 연구는 국제학술지 'Biochemical and Biophysical Research Communications(BBRC)' 온라인판에 공개됐다.(논문명: c-Fos is necessary for HGF-mediated gene regulation and cell migration in Schwann cells.)
HGF는 여러가지 활성을 가지는 다기능성 성장인자로서 중추신경계에도 작용하는 '신경영양인자(neurotrophic factor)'로도 알려져 있지만 어떤 원리를 통해 기능하는지는 규명되지 못했다.
바이로메드 연구팀은 지난 5월 HGF가 신경손상 시(말초신경계의 미엘린 수초를 형성하는) 슈반세포를 활성화 시켜서 말초신경을 재생할 수 있다는 것을 국제학술지에 발표한 바 있다. 그러나 HGF가 어떻게 슈반세포에서 이와 같은 변화를 유도하는지는 명확하지 않았다. 또한 신경이 손상됐을때 슈반세포에서 c-Fos라는 단백질의 발현이 증가한다고 알려져 있었는데 이 또한 그 원리가 밝혀진 바 없었다.
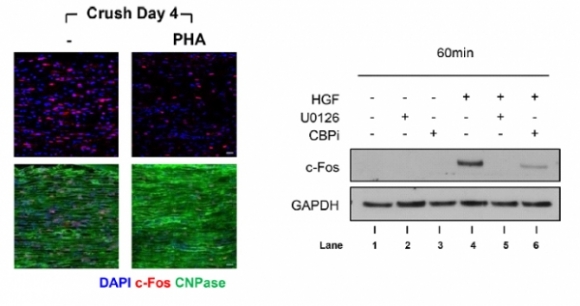
연구팀은 말초신경이 손상됐을때 HGF의 양이 증가하는데 HGF가 슈반세포에서 c-Fos의 발현을 올리는 것을 밝혔다. c-Fos는 AP-1이라는 전사인자를 구성하는 2개 단백질 중의 하나로 AP-1은 신경손상과 신경재생 시에 중요한 역할을 하는 전사인자이다.
연구팀은 슈반세포에서 HGF가 어떻게 c-Fos의 발현을 증가시키는지를 구체적으로 밝혔다. HGF가 슈반세포에 작용하면 여러 종류의 신호전달 시스템을 활성화 시키는데 그 중에서도 특히 ERK/CREB이라는 신호전달 경로가 활성화돼 c-Fos의 발현을 증가시킴을 확인했다.
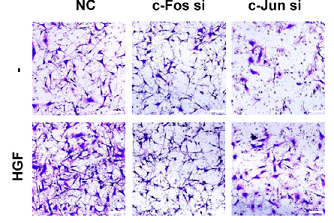
또한 슈반세포에서 HGF에 의한 c-Fos의 발현을 저해했을때 슈반세포의 활성이 감소하는 것도 확인했다. HGF가 슈반세포에 작용하면 슈반세포에서 신경영양 인자(GDNF, LIF 등)의 발현 및 세포의 이동이 증가하게 되는데 c-Fos의 발현이 저해되면 이러한 현상이 저해된다. 이는 슈반세포의 활성이 c-Fos 전사 인자를 통해 조절됨을 의미한다.
김선영 대표이사는 "이번 연구를 통해 HGF가 슈반세포에서 c-Fos를 증가시켜 손상된 신경을 복구시킬 수 있다는 것을 처음으로 밝혔다. 특히 VM202가 어떻게 망가진 신경을 고치고, 장기간 진통 효과를 내는지를 이해하는데 도움이 됐다"면서 "이번 발견은 VM202가 슈반세포에 작용해 여러 종류의 신경질환에 사용될 수 있다는 것을 의미하는 것이어서 확장성이 매우 클 수 있음을 시사한다"고 강조했다.
| 바이로메드, 샌디에고 생산시설의 풀가동을 위해 전문가들 본격 영입 (0) | 2018.08.14 |
|---|---|
| 바이로메드, HGF유전자의 신경재생 원리를 밝혀 국제학술지 게재 VM202의 disease modifying 능력을 입증 (0) | 2018.08.13 |
| 합병증이 더 무서운 당뇨병… ‘신경병증’ 주의를 [출처]합병증이 더 무서운 당뇨병… ‘신경병증’ 주의를-서울대학교 의과대학 국민건강지식센터 (0) | 2018.08.09 |
| 까다로운 'FDA 승인' 잇단 도전… K바이오 '美 상륙작전' 속도 낸다 (0) | 2018.08.09 |
| "제약바이오주, 장기적으론 상승 추세 지속" (0) | 2018.08.07 |
당뇨병 환자가 꾸준히 늘고 있다. ‘세계 당뇨병의 날’인 지난 14일 건강보험심사평가원 발표에 따르면 지난해 당뇨병 진료를 받은 인원은 258만명으로 5년 새 41만명(19%) 증가했다. 연령별 환자는 70대 이상이 29.8%로 가장 많았다.
당뇨병은 혈중 포도당의 농도가 비정상적으로 높아지며 소변으로 포도당이 배출되는 대사질환의 일종이다.
당뇨병은 병 자체보다 합병증이 더 무서운 병이다. 국민건강보험공단에 따르면 전체 당뇨 환자의 50% 이상이 합병증을 앓는 것으로 나타났는데, 이 중 당뇨병성 신경병증 환자가 28%가량으로 가장 많다.
◆당뇨 합병증 1위 신경병증, 심하면 족부절단까지
당뇨병성 신경병증으로 인한 통증은 당뇨 진단 5∼10년 뒤부터 많이 나타나기 시작한다. 60대에서 가장 많이 발생해 노인 당뇨병 환자의 경우 특히 신경병증을 조심해야 한다.
당뇨병성 신경병증의 대표 증상은 ‘통증’과 ‘이상감각’이다. 양쪽 발끝 부위부터 시작해 밤에 더욱 심해지는 특징이 있다. 구체적인 증상은 개인에 따라 다른데 작열감, 무감각 등이 나타나기도 하며 ‘전기 자극을 받는 것 같다’, ‘칼로 베거나 찌르는 듯하다’, ‘한여름에도 손발이 시려 얼어버린 것 같다’고도 표현된다. 통증과 이상감각은 수면장애나 우울증 등 2차 질환으로 이어져 환자의 삶의 질을 저하시킨다. 실제 당뇨병성 신경병증성 환자의 경우 수면 만족도가 100점 중 32.69점에 불과했으며, 삶의 만족도가 67.65점에 머물러 일반 당뇨병 환자(74.29점)나 일반인(90점)보다 현저히 낮게 나타났다.
당뇨병성 신경병증은 치료 시기를 놓치면 감각 저하로 족부질환이 발생할 가능성이 높다. 이는 족부궤양 및 족부절단으로 이어질 수 있다. 한번 발생한 족부궤양이 족부 감염으로 이어지고, 치유되지 않는 감염증으로 다리를 절단하는 상황까지 발생하는 것이다. 족부궤양 환자의 14∼24%는 하지 절단을 경험하게 되며, 궤양 발생 5년 내 사망률은 43∼55%로 나타난다. 이 때문에 당뇨병성 신경병증은 조기 진단이 중요하다.
당뇨병 합병증 중 가장 높은 비율을 차지하는 신경병증은 족부질환으로 나타날 가능성이 높으므로 당뇨 환자는 혈당 조절과 함께 발 관리를 철저히 하는 것이 중요하다. 사진은 당뇨병 전문의가 당뇨병성 신경병증 환자의 발을 수술하는 모습.
세계일보 자료사진
◆꾸준한 발 관리와 정상혈당 유지
당뇨병성 신경병증의 경우 환자에 따라 참을 수 없는 통증을 호소할 수도 있지만 별다른 증상이 없이 진행되는 경우도 50%에 달한다. 따라서 모든 당뇨병 환자는 증상이 없는 경우에도 당뇨병성 신경병증 검사를 받아야 한다. 환자의 감각을 측정하는 ‘10그램 모노필라멘트검사’나 사전 문진 시스템을 통해 당뇨병성 신경병증 통증 여부를 진단할 수 있다. 이를 통해 증상이 의심될 경우 반드시 전문의에게 신경병증 여부를 확인해야 한다.
증상이 나타나더라도 혈액순환 문제나 노화 증상의 일부로 치부하고 방치하는 환자도 많다. 당뇨병 환자라면 스스로 발의 감각을 자주 확인하고 의심해봐야 한다. 이상 증상이 느껴지는 경우 바로 병원을 찾아 진단을 받는 게 좋다.
당뇨병성 신경병증은 근본적 원인인 고혈당을 관리하는 치료와 통증 증상을 관리하는 치료로 나뉜다. 기타 당뇨병 합병증과 마찬가지로, 규칙적인 운동과 식사를 통해서 정상 혈당 및 표준 체중을 유지하는 것이 기본이다. 혈당 조절은 당뇨병성 신경병증의 1차적 예방 효과뿐 아니라 증세 완화에도 도움이 된다. 대한당뇨병학회에서는 식전 혈당 70~130㎎/dL, 식후 2시간 혈당 90~180㎎/dL을 바람직한 혈당 목표 기준으로 제시하고 있다. 또한 흡연, 중성지방 증가, 고혈압 등은 신경병증 발생과 관련이 있으므로 철저히 관리하도록 한다.
매일 하루 한 번 이상 발을 살펴보는 것도 중요하다. 상처나 물집, 홍반 혹은 피부 색의 변화, 건조함, 갈라짐 등이 없는지 잘 살펴본다. 발바닥은 보기 어려울 수 있으므로 거울을 사용하도록 한다. 발을 씻을 때에는 발가락 사이도 신중히 잘 씻고, 화상 예방을 위해 팔꿈치나 손으로 물 온도(37도 이하)를 측정하는 것이 좋다. 무엇보다 당뇨병 전문의와 정기적인 상담을 통해 자신에게 맞는 약을 처방 받고 꾸준히 치료를 받는 것이 중요하다.
| 바이로메드, HGF유전자의 신경재생 원리를 밝혀 국제학술지 게재 VM202의 disease modifying 능력을 입증 (0) | 2018.08.13 |
|---|---|
| 바이로메드 "VM202 'HGF유전자' 신경재생 원리 규명" (0) | 2018.08.11 |
| 까다로운 'FDA 승인' 잇단 도전… K바이오 '美 상륙작전' 속도 낸다 (0) | 2018.08.09 |
| "제약바이오주, 장기적으론 상승 추세 지속" (0) | 2018.08.07 |
| 바이로메드 "中 노스랜드, 3상용 VM202 대량 확보" (0) | 2018.08.07 |

세계 최대 제약 시장인 미국 진출을 눈앞에 둔 국산 의약품이 늘고 있다. 2003년 LG생명과학의 항생제 ‘팩티브’가 국내 최초로 미국 식품의약국(FDA) 허가를 받은 이후 15년간 미국에서 승인을 획득한 국산 제품은 9개다. 2003년부터 10년간은 전무했고 2013년부터 최근 5년간 8개 제품이 FDA 관문을 통과했다. 그동안 연구개발(R&D)에 투입해온 노력이 결실을 보이고 있다는 평가다. 국내 제약바이오기업이 임상 마지막 단계인 3상을 진행 중이거나 완료한 제품은 10여 개다. 이 중 FDA에 신약 승인 신청서(NDA)를 제출하고 허가를 기다리는 품목도 적지 않다. 올해를 기점으로 글로벌 시장을 겨냥한 국내 기업이 많아질 것이란 전망이다.
고배 마셨던 제약사들의 재도전
올해는 FDA의 깐깐한 심사 조건을 충족하지 못했던 기업들이 재도전한다. 셀트리온은 지난 6월 바이오시밀러 ‘허쥬마’의 품목 허가를 위한 추가 보완자료를 FDA에 제출했다. 대웅제약도 2일 보툴리눔 톡신 ‘나보타’의 허가를 받기 위해 보완 자료를 제출했다. FDA가 두 회사에 최종 보완요구공문(CRL)을 요구한 데 따른 것이다. 허쥬마는 올 하반기, 나보타는 내년 승인을 받을 것으로 예상된다.
GC녹십자도 면역 결핍증 치료제 ‘IVIG-SN’의 FDA 허가를 기다리고 있다. 지난해 미국 허가가 나올 것으로 예상됐지만 FDA로부터 제조 공정상 문제를 지적받아 허가가 지연됐다. GC녹십자는 문제를 보완하고 서류를 제출해 연내 최종 허가를 받을 것으로 기대하고 있다.
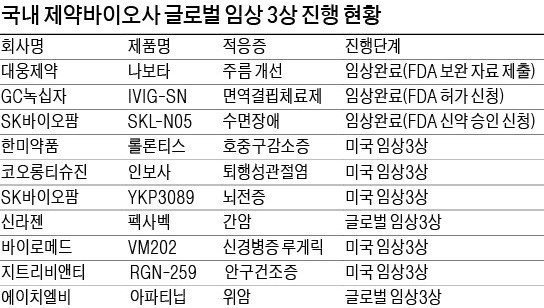
임상 3상 속도 내는 K바이오
미국에서 환자를 대상으로 임상 3상에 속도를 내는 회사도 있다. 코오롱티슈진은 지난달 미국에서 골관절염 치료제 ‘인보사’의 임상 3상에 돌입했다. 미국에서는 연골재생 여부를 입증해 근본적치료제로 허가받는다는 계획이다. 2021년까지 미국 내 품목 허가를 받는 게 목표다. 한미약품이 2012년 미국 스펙트럼에 기술수출한 호중구감소증 치료제 ‘롤론티스’는 임상 3상 결과가 최근 발표됐다. 경쟁 약물인 ‘뉴라스타’와 부작용 발현이 비슷했지만 약물 안전성이 높은 것으로 나타났다. 스펙트럼은 올 4분기에 FDA 허가를 신청할 계획이다.
바이로메드의 당뇨병성 신경병증 유전자치료제 ‘VM202’는 미국 임상 3상 막바지 단계에 접어들었다. 바이로메드는 미국 DNA 생산시설을 인수하고 제품 상용화를 준비하고 있다. 신라젠의 항암바이러스 치료제 ‘펙사벡’은 내년 말 임상 종료를 목표로 말기 간암 환자를 대상으로 글로벌 임상 3상을 진행 중이다. 하반기에는 임상 중간 결과를 발표할 예정이어서 주목된다.
SK바이오팜과 삼성바이오에피스는 임상 3상을 이미 완료하고 허가를 기다리고 있다. SK바이오팜의 수면장애 치료제 ‘SKL-N05’는 지난 3월 FDA의 승인 검토에 들어가 이르면 연내 허가를 받을 것으로 보인다. 삼성바이오에피스의 허셉틴 바이오시밀러 ‘온트루잔트’는 지난해 12월 FDA에 판매 허가 신청해 심사 중이다. 유럽에서는 지난해 11월 허가를 받고 판매하고 있다.
| 바이로메드 "VM202 'HGF유전자' 신경재생 원리 규명" (0) | 2018.08.11 |
|---|---|
| 합병증이 더 무서운 당뇨병… ‘신경병증’ 주의를 [출처]합병증이 더 무서운 당뇨병… ‘신경병증’ 주의를-서울대학교 의과대학 국민건강지식센터 (0) | 2018.08.09 |
| "제약바이오주, 장기적으론 상승 추세 지속" (0) | 2018.08.07 |
| 바이로메드 "中 노스랜드, 3상용 VM202 대량 확보" (0) | 2018.08.07 |
| 김선영 바이로메드 대표 "美 생산시설 인수...'VM202' 상용화 8부능선 넘었다" 출처 : http://www.sedaily.com/NewsView/1S38RQ8JV1 (0) | 2018.08.05 |
"단기 추세로 진폭이 큰 사이클이 나타나는 것…시총 큰 기업의 진전 필요한 때"

<© 2018 메디파나뉴스, 무단 전재 및 배포금지>'대한민국 의약뉴스의 중심'메디파나뉴스
| 합병증이 더 무서운 당뇨병… ‘신경병증’ 주의를 [출처]합병증이 더 무서운 당뇨병… ‘신경병증’ 주의를-서울대학교 의과대학 국민건강지식센터 (0) | 2018.08.09 |
|---|---|
| 까다로운 'FDA 승인' 잇단 도전… K바이오 '美 상륙작전' 속도 낸다 (0) | 2018.08.09 |
| 바이로메드 "中 노스랜드, 3상용 VM202 대량 확보" (0) | 2018.08.07 |
| 김선영 바이로메드 대표 "美 생산시설 인수...'VM202' 상용화 8부능선 넘었다" 출처 : http://www.sedaily.com/NewsView/1S38RQ8JV1 (0) | 2018.08.05 |
| RMAT 지정 약물 사례를 통한 학습 (Naver 카페) (0) | 2018.08.04 |
http://biospectator.com/view/news_view.php?varAtcId=5971
바이오스펙테이터 장종원 기자

바이로메드는 7일 중국 파트너사인 노스랜드 바이오텍(베이징 소재)이 중국 3상에 사용할 '재조합 인간 간세포 성장인자 플라스미드 주사액(NL003)'의 500리터 규모 생산을 성공적으로 완료했다고 밝혔다.
NL003은 바이로메드가 개발한 VM202의 중국 버전으로서 VM202와 동일한 원료 물질인 pCK-HGF-X7으로 구성돼 있다. 노스랜드 바이오텍은 NL003을 이용한 중증하지허혈 유전자 치료제 임상 2상을 성공적으로 완료하고 작년 10월 중국 FDA로부터 임상 3상 승인을 받은 바 있다.
플라스미드 DNA는 중국뿐만 아니라 전세계적으로도 품목허가를 받은 사례가 없기 때문에 대량 생산 조건을 확립하는 것은 임상3상 진입과 상용화를 위한 필수 조건이다. 노스랜드 바이오텍 연구팀은 다년간의 노력을 통해 플라스미드의 생산과정인 발효와 정제 공정을 확립하고 최적화해 플라스미드 DNA 주사액의 대량 생산을 완료했다.
노스랜드 바이오텍의 허송산(Xu Songshan) 회장은 "재조합 인간 간세포 성장인자 플라스미드 DNA 주사액의 대량생산이 성공적으로 완료됨에 따라 중국 임상3상 시험에서 사용할 의약품의 준비가 끝났다"면서 "향후에는 더욱 자동화되고 지능적인 대규모 생산 시스템을 구축할 것”이라고 말했다.
바이로메드의 김선영 대표이사는 “노스랜드 바이오텍은 VM202의 중국 상용화 준비의 중요한 마일스톤인 대량생산 공정을 확보했다"면서 "중국 내 개발을 신속하게 완료하고 시장에 나가려는 노스랜드 바이오텍의 강력한 의지를 엿볼 수 있다”고 전했다.
한편 바이로메드는 최근 미국 캘리포니아 샌디에이고에 있는 DNA 생산시설을 인수하는 계약을 맺었다. 바이로메드는 이 공장을 통해 유전자치료제 임상에 사용되는 플라스미드 DNA를 안정적으로 생산할 계획이다.
| 까다로운 'FDA 승인' 잇단 도전… K바이오 '美 상륙작전' 속도 낸다 (0) | 2018.08.09 |
|---|---|
| "제약바이오주, 장기적으론 상승 추세 지속" (0) | 2018.08.07 |
| 김선영 바이로메드 대표 "美 생산시설 인수...'VM202' 상용화 8부능선 넘었다" 출처 : http://www.sedaily.com/NewsView/1S38RQ8JV1 (0) | 2018.08.05 |
| RMAT 지정 약물 사례를 통한 학습 (Naver 카페) (0) | 2018.08.04 |
| 바이로메드, 김선영 단독 대표이사 체제로 전환 "VM202 임상 3상 종료 앞두고 변화 필요성" (0) | 2018.08.03 |
이제 거의 다 종착점에 도착함... 새로운 출발선에 대기..
====================================================
http://www.sedaily.com/NewsView/1S38RQ8JV1
|
|
출처 : http://www.sedaily.com/NewsView/1S38RQ8JV1
| "제약바이오주, 장기적으론 상승 추세 지속" (0) | 2018.08.07 |
|---|---|
| 바이로메드 "中 노스랜드, 3상용 VM202 대량 확보" (0) | 2018.08.07 |
| RMAT 지정 약물 사례를 통한 학습 (Naver 카페) (0) | 2018.08.04 |
| 바이로메드, 김선영 단독 대표이사 체제로 전환 "VM202 임상 3상 종료 앞두고 변화 필요성" (0) | 2018.08.03 |
| 매일경제 2015년 김선영 박사 인터뷰 (0) | 2018.08.02 |
네이버 카페에 올라온 정말 정리 잘 된 글입니다. 작성자에게 감사의 인사를...
===========================================
https://cafe.naver.com/viromed/10306
것을 알게되었습니다.
그래서 괜히 올렸다가 카페에 혼선을 주는건 아닌가 싶어 고민하다가 다양한 시각에서 검토와 의견 논의야 말로 집단지성의 발전이 아닐까 생각되어 용기내어 올려봅니다.
첫번째, 사례를 보기에 앞서 먼저 저희가 알아야할 것은 RMAT의 정의입니다.
지난 5/21일 회사 RMAT 공시를 보면, RMAT는 2016년 12월 탄생한 제도로 혜택으로 FDA가 시행중인 신속 개발 프로그램 중 패스트트랙(Fast Track)과 혁신의약품(Breakthrough therapy)의 혜택을 포함하고 있음 이라고 설명하고 있습니다.
즉, 이는 저희가 사례를 찾아볼 때 RMAT와 Fast track, BT까지 확장해서 보아야 한다는 것입니다.
두번째, 사례 검토 범위 확대와 제약에 대한 내용입니다.
RMAT는 분명 Fast Track, Breakthrough Therapy의 혜택을 포함합니다. 하지만 근본적으로 FDA가 정의하는 카테고리가 다르고 세부적인 차이가 있습니다. 그렇다면 여기에서 의문은 "과연 FT와 BT 사례를 보는것은 유의미한 것일까?" 라는 겁입니다. 저도 아직 확실한 답을 구하지 못했습니다.
2018년 7월 3일 기준 총 21개의 약물이 RMAT에 지정되어 있습니다. 또한 21개 약물은 각기 질환대상과 적응증이 다양합니다.
현재 제 결론은 "VM202와 유사Case는 있어도 동일Case는 없다. RMAT사례 분석으로 VM202의 기대 소요기간을 절대적으로 추정할 수 없다. 다만 다양한 사례를 통해 RMAT의 프로세싱과 FDA의 대응 속도 등에 대한 근본적인 팩트만 참고하자" 입니다.
RMAT, FT, BT 정의/비교에 대한 다양한 자료가 있지만 그냥 참고로 사진 두장을 올립니다.

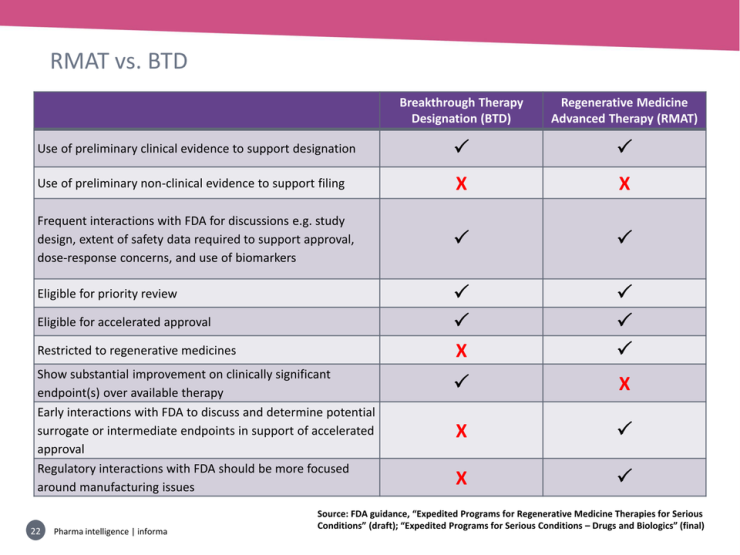
세번째, RMAT 사례 분석입니다.
먼저 RMAT 지정이 된 약물 중 Phase 3까지 진행된 것과 Phase 2까지 진행된 것을 구분하여 조사하고,
그외 카페를 통해 알게된 FT,BT 사례를 확인해보았습니다.
(지구력이 다하여 Phase 1에서 RMAT 받은것은 스킵하였습니다.)
아래 글은 제가 따로 노트에 메모한 내용인데 다소 보기 힘드시더라도 양해바랍니다.
여기에서 관심있게 모니터링 해야할 약물은 아래 내용에서 노란색으로 표시되어 있습니다.
==========================================================================================================
===================================================================
마지막으로 여기에서 저희가 관심을 가져야 할 내용입니다.
1. Enzyvant사의 RVT-802 : 2상진행중이며 2017년 4월 RMAT를 받았고 2018년 7월 FDA에 Rolling BLA 제출동의를 받아, 부분적인 Wave를 실시하고 있다는 것. 그리고 2018년 말까지 BLA 승인을 목표로한다는 것입니다.
즉, 2상에서 BLA승인 가능성. 그리고 VM202의 Rolling BLA 시도 등을 대입해 볼 수 있겠습니다.
2. Humacyte사의 humacyl : 3상진행중이며 2017년 9월에 환자모집 완료를 완료했다는 것.
즉 현 단계가 Follow-up(현재 12개월로 추정중)과정에 있다는 것과 RMAT가 있다는 것. 이는 바메와 가장 유사한 길을 걷는 사례라는 점입니다.
3. Avexis의 AVXS-101 : 3상 진행 중 2020년 3월 임상 완료 예정,회사측에서 2018년 하반기 Pre-BLA 미팅, 2019년 약출시 목표.
3상 종료전에 BLA 진행 과정과 FDA 반응은?
===========================================================================
두번째로 RMAT 승인된 Enzyvant 회사의 RVT-802 신약입니다.
2018.07.09,, 아마도 첫번째로 FDA로부터 <<롤링 BLA 제출 프로세스>> 동의를 획득했네요.
==> 제 구글링 실력으론 첫번째로 나옵니다만, 오류시 본문 글 수정하겠습니다.
아래 구글 번역에 나와 있듯이 올해 12월까지 BLA제출 완료를 목표로 한다고 합니다.
위 내용을 근거로 하면,, BLA의 총 소요기간은 10개월이였으나 RMAT 지정으로 6개월로 단축된다는
제도에 부합하는 내용이네요.
김선영교수님이 BLA를 위한 FDA 컨택을 올 9월에 시작한다고 말씀하셨는데,
아마도 하반기에 롤링 BLA 제출을 시작할 수 있으면,
아무리 늦어도 내년 중순쯤엔 BLA 종료를 선언할 수 있지 않을까 생각해 봅니다.
▶ 아래표에서 보시면, 17.4월 RMAT 지정 당시는 임상2상 중이였네요.
바이로메드는 당시 임상 3상이였으니 .. 바메도 BLA 시작할 때가 된거 같기도 하구요,,
RVT-802의 임상2상, 3상 시작시점과 끝을 아무리 구글링해도 못 찾겠네요. 회사 홈피에도 정보가 없구요, 힘드네요.
** 메리츠 이태영 자료 참조 (2018. 7. 16)
▶ BLA 제출 시작 기사 - 18년 7월 9일
Enzyvant Announces Initiation of RVT-802 Rolling BLA Submission for the Treatment of Complete DiGeorge Anomaly
Rolling BLA submission has been agreed to by FDA and is intended to expedite the Agency's review process
Completion of rolling BLA submission anticipated by end of 2018
RVT-802 has been awarded Breakthrough Therapy and RMAT designations, as well as pediatric rare disease and orphan designations
Enzyvant to present at Roivant Pipeline Day on July 10
<<헤드라인 번역>>
Enzyvant, 완벽한 DiGeorge Anomaly 치료를위한 RVT-802 Rolling BLA 제출 개시
롤링 BLA 제출은 FDA의 동의를 받았으며 식품 기준 청의 검토 절차를 신속히 진행할 예정입니다.
2018 년 말로 예상되는 롤링 BLA 제출 완료
RVT-802는 소아용 희귀병 및 고아 지정뿐만 아니라 Breakthrough Therapy 및 RMAT 지정을 받았습니다.
7 월 10 일 Roivant Pipeline Day에서 발표 할 Enzyvant
===============================================================
<< 본문 구글 해석>>
희귀 질환 환자를위한 혁신적인 치료제 개발에 주력하는 바이오 제약 회사 Enzyvant는 RVT-802를위한 생물학적 허가 신청서 (BLA)의 롤링 제출을 오늘 시작했다고 발표했다. 미국 식품의 약국 (FDA)에 제출해야합니다. 회사는 2018 년 말까지 BLA 제출을 완료 할 것으로 예상됩니다.
RVT-802는 완전한 DiGeorge Anomaly (cDGA)와 관련된 선천적 인 athymia로 인한 초기 면역 결핍을 치료하기 위해 고안된 연구, 조직 기반 재생 치료법입니다. RVT-802는 환자의 평생 동안 한 번만 관리하도록 설계되었습니다. cDGA는 치료를받지 않으면 균일하게 치명적이며, 감염의 감수성으로 인해 생후 24 개월 이내에 전형적으로 사망합니다.
RVT-802에는 획기적인 치료 지정, 재생 의학 고급 치료 (RMAT) 지정, 드문 소아 질환 지정 및 FDA의 고아 약 지정이 부여되었습니다. 높은 충족되지 않은 의료 요구를 해결하고자하는 FDA의 노력의 일환으로 FDA는 RVT-802에 대한 롤링 BLA 제출 프로세스에 동의했다.
엔 지탱 트 (Enzyvant)의 알빈 쉬 (Alvin Shih) 최고 경영자는 "우리는 RVT-802 BLA 제출을 시작하게되어 매우 기쁘게 생각합니다. 이것은 엔 자당 트의 경우뿐만 아니라 cDGA 및 그 가족의 영아에게도 중요한 이정표가되었습니다. "이 혁신적인 프로그램을 추진하기 위해 끊임없이 노력한 팀 전체에 감사드립니다. 우리는 2018 년에 BLA를 완수하여 EPA가 철저하고시기 적절한 검토를 할 수 있도록 계속 목표를 추진할 것입니다."
Shih 박사는 내일 오후 7 시부 터 오후 5시에 뉴욕시의 Roivant Pipeline Day에서 발표 할 예정입니다.
Roivant Sciences의 설립자이자 CEO 인 Vivek Ramaswamy는 "이 치명적인 상태로 고통받는 환자의 삶을 개선하기위한 Enzyvant의 헌신을 자랑스럽게 생각합니다. "로이 반트의 성공에 대한 궁극적 인 기준은 심각한 질병으로 고통받는 환자들에게 진정으로 혁신적인 치료법을 제공하는 것입니다. 오늘 발표는 우리 회사의 역사에서 중요한 이정표가되었습니다."
DiGeorge Anomaly의 완벽한 완성
완전한 DiGeorge Anomaly (cDGA)는 미국에서 매년 출생 한 신생아 약 10 만 ~ 20 만 명 중 약 1 명에 영향을 미치는 희귀 질환입니다. cDGA를 가진 어린이는 흉선없이 태어나서 정상적인 기능을하는 T 세포를 생성 할 수 없기 때문에 심한 면역 결핍을 초래합니다. T 세포는 감염을 막고 면역계의 필수 과정을 조절합니다. cDGA는 치료를받지 않으면 균일하게 치명적이며, 감염의 감수성으로 인해 생후 24 개월 이내에 전형적으로 사망합니다.
RVT-802 정보
RVT-802는 cDGA와 관련된 선천적 인 athymia로 인한 1 차 면역 결핍을 치료하기 위해 고안된 연구 조직 기반 재생 치료입니다. RVT-802는 조사 중이며 현재 FDA 또는 기타 건강 관리 기관에서 상업적 용도로 승인하지 않았습니다.
Enzyvant 정보
Enzyvant는 희귀 질환 환자를위한 혁신적인 치료법 개발에 주력하는 생물 약제 회사입니다. Enzyvant는 Duke 대학과 공동으로 DiGeorge Anomaly와 관련된 원발 면역 결핍 치료를위한 연구 조직 기반 치료법 인 RVT-802의 개발을 진전시키고 있습니다.
Enzyvant는 Farber 질환 치료를위한 연구용 효소 대체 요법 인 RVT-801의 임상 시험을 동시에 시작할 준비를하고 있습니다. Enzyvant는 높은 희귀병이 필요한 추가 희귀 질병 치료법을 개발할 계획입니다.
▶ RMAT 획득 기사 - 17년 4월 17일
Enzyvant Receives FDA Breakthrough Therapy Designation and Regenerative Medicine Advanced Therapy Designation for Investigational Therapy RVT-802
===================================
<< 본문 구글 해석>>
- RVT-802는 DiGeorge 증후군 완전 치료를위한 임상 적 생물학적 요법으로 치료받지 않으면 희귀 한 소아 질환입니다.
- RVT-802는 RMAT 지정을받는 최초의 치료 요법 중 하나입니다.
- Enzyvant, 2018 년 상반기 BLA 제출 가능성 예상
희귀 질환 환자를위한 혁신적인 치료제 개발에 주력하는 바이오 제약 회사 Enzyvant는 미국 식품의 약국 (FDA)이 Enzyvant의 연구 조직인 RVT-802를 부여했다고 발표했다. (DiGeorge Syndrome) 치료법, 획기적인 치료법 지정 및 재생 의학 고급 치료법 (RMAT) 지정을위한 기초 요법입니다. 두 지정 모두 개발 지침 및 신속 검토 경로를 위해 조직 및 고급 치료 사무소에 대한 특별 액세스 권한을 부여합니다.
"우리는 RVT-802가 획기적인 치료법 지정을 받았다는 것을 기쁘게 생각하며 RMAT 지정을받는 첫 번째 프로그램 중 하나임을 영광으로 생각합니다."라고 Enzyvant의 Alvin Shih 최고 경영자는 전하면서, "우리는 치료 후보 RVT-802를 가능한 한 신속하고 책임감있게 cDGS 환자에게 제공 할 수 있도록 FDA와 긴밀히 협력하기를 기대합니다."
Duke 대학의 소아과 교수이자 RVT-802의 발명가 인 M. Louise Markert 박사는 "오늘의 발표는 앞으로 DiGeorge가있는 어린이들이 잠재적으로 생명을 구하는이 치료법에 적시에 액세스 할 수 있기를 희망합니다.
Roivant Sciences의 설립자이자 CEO 인 Vivek Ramaswamy는 "Roivant 가족 전체를 대표하여 우리는 유망한 치료를위한이 획기적인 이정표를 자랑스럽게 생각합니다. "이것은 우리 팀에게는 중요한 순간이며,이 끔찍한 질병에 직면 한 가족에게는 가장 중요합니다. 우리는 희귀 질환으로 고통받는 환자에게 RVT-802 및 기타 잠재적 인 변형 치료법을 제공하겠다는 임무에서 Enzyvant를 지원하기를 기대합니다. "
획기적인 치료법 지정은 심각한 또는 생명을 위협하는 상태의 약물 개발 및 검토를 신속하게하기위한 것입니다. 그러한 지정 기준에는 약물이 유효 치료법보다 임상 적으로 의미있는 하나 이상의 종점에서 실질적 개선이있을 수 있다는 예비 임상 증거가 포함됩니다.
RMAT 지정은 2016 년 12 월에 법으로 서명 된 21 세기 치료법의 구성 요소입니다. 적격 약물에는 세포 요법, 치료 조직 공학 제품, 인간 세포 및 조직 제품 또는 이러한 요법 또는 제품을 사용하는 복합 제품이 포함됩니다. 이 자격을 얻으려면 자격이되는 약품이 심각하거나 생명을 위협하는 질병이나 상태를 치료, 수정, 역전 시키거나 치료해야하며, 그러한 질병에 대한 충족되지 않은 의학적 필요를 해결할 잠재력이 있음을 나타내는 예비 임상 증거가 있어야합니다. 조건.
================
Enzyvant is the second company to announce the receipt of RMAT designation for an investigational drug and the first to announce the simultaneous receipt of RMAT and Breakthrough Therapy designations.
Enzyvant는 rmat 지정을 받은 두 번째 회사이자 rmat와 BT를 동시에 수령한 첫 번째 회사이다.
=================
완벽한 DiGeorge 증후군에 관하여
완전한 DiGeorge Syndrome (cDGS)은 선천적 인 DiGeorge 증후군 환자의 약 1 %를 차지합니다. cDGS의 세 가지 주요 특징은 선천성 심장병, 부갑상선 기능 항진증 (낮은 칼슘 수치로 이어진다), 및 athymia (흉선 조직 부족)입니다. 아티 미아는 정상적인 기능을하는 T 세포를 생산할 수 없기 때문에 심한 면역 결핍을 초래합니다. T 세포는 감염을 막고 면역계의 필수 과정을 조절합니다. cDGS는 치료를받지 않으면 균일하게 치명적이며, 감염에 대한 감수성으로 인해 일반적으로 생후 2 년 이내에 사망합니다.
RVT-802 정보
RVT-802는 cDGS로 인한 원발성 면역 결핍 치료를 위해 동종 흉선 조직을 채취, 배양 및 적용하기 위해 독점적 인 프로세스를 사용하는 연구 용 생물학적 요법입니다. 예비 임상 결과는 치료받은 환자의 생존율이 70 %를 넘는 것으로 나타났습니다. 획기적인 치료 지정 및 재생 의학 고급 치료 지정 외에도 RVT-802에는 FDA의 고아 약 지정이 부여되었습니다. Enzyvant는 2018 년 상반기에 BLA를 제출할 것으로 예상하고 있습니다. RVT-802는 현재 임상 시험 중이며 FDA 또는 기타 건강 관리 기관에서 상업적 용도로ㅁ 승인하지 않았습니다.
| 바이로메드 "中 노스랜드, 3상용 VM202 대량 확보" (0) | 2018.08.07 |
|---|---|
| 김선영 바이로메드 대표 "美 생산시설 인수...'VM202' 상용화 8부능선 넘었다" 출처 : http://www.sedaily.com/NewsView/1S38RQ8JV1 (0) | 2018.08.05 |
| 바이로메드, 김선영 단독 대표이사 체제로 전환 "VM202 임상 3상 종료 앞두고 변화 필요성" (0) | 2018.08.03 |
| 매일경제 2015년 김선영 박사 인터뷰 (0) | 2018.08.02 |
| 바이로메드, 김선영 1인 대표이사 체제로 전환 (0) | 2018.08.01 |
RECENT COMMENT