검색결과 리스트
바이오종목/Helixmith(바이로메드)에 해당되는 글 275건
- 2018.08.27 [임상/연구개발] 생산시설 동등성시험
- 2018.08.27 [포럼] 연구실이 創業전진기지가 돼야 한다
- 2018.08.25 Korean biotech buys GMP-ready production facility in California
- 2018.08.25 바이로메드 8월 23일 ir 자료 - 네이버 와이티님 블로그
- 2018.08.24 5 Korean biopharmaceuticals most active in P3 trials in 5 years
- 2018.08.22 VIROMED미국 현지 법인 COO : Keith Hall
- 2018.08.21 ViroMed Secures DNA Production Facility in the US
- 2018.08.18 '고무줄 회계' 연구개발비, '자산→비용' 처리 변화
- 2018.08.18 바이로메드 주담 통화 내용
- 2018.08.15 난치병 치료 유전자치료제 미래신약 주목…국내 임상만 67건
글
Viromed web page에 올라온 글입니다.
생산시설 동등성 시험은 매우 용이하며, 시간과 비용도 훨씬 적게 들것으로 추정...
작은 노이즈에 신경쓰지 말고 신약 출시되면 매출과 순이익이 얼마 될지 크게 상상해주세요..
http://viromed.co.kr/bbs/index.php?code=bbs_kor_faq
바이오시밀러 약물의 동등성 입증(similarity assessment)은 오리지널 의약품과 바이오시밀러를 비교하여 바이오시밀러가 ①오리지널 의약품과 동일한 제품으로 생산이 가능한지, ②바이오시밀러가 체내에서 작용하는 원리와 효과가 오리지널 의약품과 동일한지를 증명하는 시험입니다. 생산 시설/환경이 변경될 경우 수행하는 동등성 시험(comparability study)은 생산시설, 공정 등 생산 환경의 변경에 대하여 변경 전 제품과 변경 후 제품이 동등(comparable) 하다는 것을 증명하는 시험입니다.
이 두가지 경우 모두 동등성 시험은 당연히 진행되어야 하는 과정입니다만, 생산 환경의 변경에 따라 진행되는 동등성 시험(comparability study)은 바이오시밀러 약물의 동등성 입증(similarity assessment)처럼
대규모 임상, 고비용, 장시간을 요하는 수준은 아닙니다. 뿐만 아니라, 플라스미드 DNA는 기존 단백질/항체(대부분 현재의 바이오시밀러 제품들)들에 비교하여 상대적으로 구조가 간단하기 때문에 생산 시설 변경에 따른 동등성 시험이 매우 용이하며, 시간과 비용도 훨씬 적게 들것으로 추정됩니다.
'바이오종목 > Helixmith(바이로메드)' 카테고리의 다른 글
| '新藥 상용화' 위해… 26년 교수직을 내려놓다 (0) | 2018.08.28 |
|---|---|
| [단독] 화이자 제약 뉴론틴(Neurontin), 리리카(Lyrica) 뇌의 시냅스 형성 막아 (연구) (0) | 2018.08.28 |
| [포럼] 연구실이 創業전진기지가 돼야 한다 (0) | 2018.08.27 |
| Korean biotech buys GMP-ready production facility in California (0) | 2018.08.25 |
| 바이로메드 8월 23일 ir 자료 - 네이버 와이티님 블로그 (0) | 2018.08.25 |
글
정부는 청년창업 지원을 통해 일자리를 창출하기 위해 많은 노력을 기울이고 있다. 각 부처와 지자체 및 공공기관 등이 경쟁적으로 청년창업 지원에 많은 예산을 퍼붓고 있지만, 기대만큼 성과가 나고 있지 않다. 창업의 성공률을 높이고 일자리 창출에도 더 많은 성과를 내려면 창업 지원 정책의 일부의 궤도를 수정할 필요가 있다.
일반창업 스타트업의 생존율은 29%인데, 교수창업 스타트업의 생존율은 그의 3배에 달하는 89%에 이른다. 청년창업 지원 자금의 일부를 교원(교수)창업으로 돌리면 청년창업보다 훨씬 높은 성과를 낼 수 있다는 얘기다. 그러므로 교수 연구실(실험실)을 창업전진기지로 삼을 것을 제안하며, 교수창업 지원 확대로 일자리 창출을 모색해야 한다고 주장하는 바이다.
그런데 정책 입안자들은 근시안적인 정책으로 청년 일자리 창출을 위해서는 청년창업을 지원하는 데에만 몰두하고 있다. 교수창업을 지원하면 청년창업보다 성공률이 3배 이상 높은데다가 일자리 창출 효과도 더 큰 것을 간과하고 있는 것이다. 대학의 창업에 대해서는 선진국과 비교해서도 많은 시사점을 얻을 수 있다.
미국 스탠포드대학교의 재학생 수는 16,336명이고, 교수 수는 2,180명이다. 국내 명문 S대학교의 재학생 수는 28,630명에 교수 수는 5,315명에 이른다. 두 대학을 비교해보면 학생 수는 국내 대학이 1.75배이고, 교수 수는 2.4배나 된다. 연구비 규모는 미국 S대학교가 10억 달러이고, 한국의 S대학교는 절반인 5억 달러이다.
두 대학의 창업 성과를 비교해보면 차이가 크다. 미국 S대학교가 배출한 창업기업(스타트업) 수는 4만개인데, 한국 S대학교의 창업기업 수는 1,250개에 불과해서 미국 대학의 32분의 1 밖에 안된다. 미국 S대학교의 신규 일자리 창출은 5백만개나 되는데, 한국 S대학교의 신규 일자리 창출은 10만개로 미국 대학의 50분의 1 밖에 안된다. 미국 S대학교가 스타트업을 통해 창출한 경제적 부가가치는 2.7조 달러(우리나라 GDP(1.2조달러)의 2.25배, 프랑스 GDP 수준)이며, 한국 S대학교가 창출한 부가가치는 미국 대학의 72분의 1인 377억달러에 불과하다.
이같은 수치를 단순 비교할 수는 없지는 비교를 통해 얻을 수 있는 시사점은 많다. 교수창업 또는 대학창업이 제대로 되면 큰 파급 효과를 낼 수 있을텐데, 국내에서는 대학창업 특히 교수창업 지원에 미흡한 점이 많아서 미국만큼 성과를 내지 못하고 있다고 본다. 국내 대학의 80%가 교수창업 0이다. 교수창업에 대한 정부와 대학의 지원이 없거나 많이 부족하기 때문이다.
교수창업을 위한 겸직이나 휴직 제도를 운영하는 대학이 147개로 전체의 35%에 불과하다. 교수의 창업 실적을 업적 평가에 반영하는 대학은 120개로 전체의 28% 밖에 안된다. 이처럼 대학들이 교수창업을 위한 지원이나 인정을 제대로 하지 않으니 교수들이 창업에 적극적이지 않을 수밖에 없다. 제도적으로 교수창업을 지원하지 않거나 지원에 소극적이므로 교수창업이 제한적일 수밖에 없는 게 한국 대학의 현실이다.
교수창업을 한 경우 대부분 겸직을 하므로 교육과 연구를 하면서 사업을 겸하게 된다. 그러므로 성과가 더딜 수밖에 없는데, 정부나 금융기관의 벤처기업 지원 대상 설립 연한을 일반 벤처기업과 동일하게 적용하는 것도 문제다. 일반적으로 설립 3년 이내 기업은 아주 쉽게 지원해주고, 3년 초과 5년 이내 기업은 지원이 조금 까다로워지고, 5년을 초과하면 지원 받기가 많이 어려워지고, 7년이 초과되면 거의 불가능하다고 한다. 이러한 기간 조건을 교수창업 기업에는 완화해서 적용해야 한다. 교수창업을 해서 벤처기업을 운영하면서 지원을 받기 위해 금융기관 등을 다녀보면 조금만 지원이 되면 큰 성과를 낼 수 있는데 지원 받기가 어려워서 안타깝다. 바이로메드와 아이센스는 대표적인 교수창업의 성공 사례로 꼽힌다. 어려운 여건 속에서도 바이로메드는 2005년에 코스닥 상장하여 시가총액이 3조 1705억원에 달하며, 아이센스는 2015년에 코스닥 상장하여 시가총액이 3,4043억원이나 된다. 교수창업 지원 정책을 확대하고 여건을 개선해준다면 교수창업 성공 사례가 훨씬 많이 나와서 일자리 창출과 경제적 부가가치 증대에 많은 기여를 할 수 있을 것으로 기대한다.
'바이오종목 > Helixmith(바이로메드)' 카테고리의 다른 글
| [단독] 화이자 제약 뉴론틴(Neurontin), 리리카(Lyrica) 뇌의 시냅스 형성 막아 (연구) (0) | 2018.08.28 |
|---|---|
| [임상/연구개발] 생산시설 동등성시험 (0) | 2018.08.27 |
| Korean biotech buys GMP-ready production facility in California (0) | 2018.08.25 |
| 바이로메드 8월 23일 ir 자료 - 네이버 와이티님 블로그 (0) | 2018.08.25 |
| 5 Korean biopharmaceuticals most active in P3 trials in 5 years (0) | 2018.08.24 |
글
Korean biotech buys GMP-ready production facility in California
설정
트랙백
댓글
Korean biotech ViroMed has seen companies miss out on approvals for novel therapies because the FDA had problems with their manufacturing processes. With its first treatment nearing the completion of phase 3 trials, the company says it has taken steps to avoid that trap.
The Seoul-based biotech this week said that in a joint venture partnership with a private equity investment firm, it had acquired a GMP ready facility in San Diego, California, from Vical Inc. Terms of the deal were not disclosed.
Until recently, the production site was used for clinical studies that included phase 3 trials in the U.S. of DNA-based investigational drugs, ViroMed said. The Korean company’s lead product VM202 (donaperminogene seltoplasmid) is a gene therapy for the treatment of painful diabetic peripheral neuropathy (PDPN).
The facility in San Diego has a 500 L fermenter, cell culture lab and quality control test lab, as well as space for expansion, ViroMed said in its announcement. With plans for test runs within this year and GMP production in the first half of 2019, the company said it is hiring key personnel to operate the facility and expects to have 25 people on board in the next few months.
The company said a comparability test will be required by regulatory authorities for the facility since the production site is different from the ones that manufactured the drug used in past and current clinical studies. ViroMed CEO Sunyoung Kim said he does not expect that to be an issue.
RELATED: VM BioPharma enters gene therapy pain candidate into PhIII
ViroMed said it is currently the only company conducting phase 3 trials in the U.S. involving plasmid DNA. It acknowledged that manufacturing will be a key consideration for approval of plasmid DNA-based gene medicines since they have never been approved and commercialized. It also expects having a manufacturing site will “boost in the company's bargaining power for potential out-licensing and marketing partnership deals.”
If approved, ViroMed’s treatment would be up against Pfizer blockbuster Lycra and Neurontin (gabapentin). Both are taken orally, while VM202 in injected, but the two marketed drugs treat only symptoms, where VM202 is designed to get at the underlying cause of the pain. ViroMed’s candidate works by inducing angiogenesis and acts as a neurotrophic factor, leading to the formation of new microvasculature and induces regeneration of nerve cells.
The FDA path to approval has certainly been littered by drugs sidelined by complete response letters tied to manufacturing problems. AstraZeneca in 2015 paid $2.7 billion for ZS Pharma to get its hands on Lokelma, formerly known as ZS-9. The treatment for hyperkalemia was expected to be a blockbuster but was twice rejected by the FDA over problems before being approved in May.
'바이오종목 > Helixmith(바이로메드)' 카테고리의 다른 글
| [임상/연구개발] 생산시설 동등성시험 (0) | 2018.08.27 |
|---|---|
| [포럼] 연구실이 創業전진기지가 돼야 한다 (0) | 2018.08.27 |
| 바이로메드 8월 23일 ir 자료 - 네이버 와이티님 블로그 (0) | 2018.08.25 |
| 5 Korean biopharmaceuticals most active in P3 trials in 5 years (0) | 2018.08.24 |
| VIROMED미국 현지 법인 COO : Keith Hall (0) | 2018.08.22 |
글
1. 미국 샌디에고 생산 시설 확보
- 사모펀드 합작 형태 jv 설립 : JENOPIS
- 500L 규모 , 향후 확장 가능한 여유 부지 확보
- 상업 생산용으로 계획을 가지고 있음.
- 미국 현지인들 채용 : KEITH HALL COO
- 세계 최초의 상업용 플라스미드 DNA 생산 시설
2. 이연제약 과의 소송 관련 : 각 사가 주장하고 있는 내용이 서로 상이하며, 바이로메드 측에서는 이연제약이 임상 원료 생산등이 되어야 글로벌 생산권이 가능하기 때문에 이연제약은 권한이 없다고 생각하고 있음.
- 중재원 판결은 1년 이상 걸릴 거로 예상되며 그 사이 협의가 필요함.
3. LO를 포기한 것은 결코 아님 : 다만 판권 이전 시 이익이 많이 되는 부분을 고려하여 판단 중
- LO 시 로열티 10% / 판권 계약시 30% + 생산 관련 매출 이익 등
4. PAD는 RMAT 진행 중 : 가능성 높다.
- 현재까지 RMAT 지정된 유전자 치료제는 5건이며 당뇨병성 신경병증 유전자 치료제로는
VM-202가 유일함.
- 2019년 말 임상 3상 완료 계획임.
5. 유상 증자 관련 : 필요할 수도 있지만 다만 현재 확정되거나 현재 지금 계획은 없다.
6. FDA 미팅은 10월 / 11월 정도 예상
7. 생산 시설 관련 인수 구체적인 내용은 곧 발표 예정
8. 미국 샌디에고 생산시설 관련 동등성 입증은 어려운 과제 아니다.
9. 주사제 투입은 환자가 원할 경우 연 4회(현재는 기본 2회)로 디자인 할 수 있음.
10. RMAT 승인으로 VM-202 DPN 임상 3-2의 생략 여부는 FDA 와 미팅시 협의될 것임.
11. PDPN 신약 후보군 중에서는 VM-202 DPN이 안정적이며 약효가 탁월하고 장기적 치료 효과가 있음.
- 근본적 치료제로의 가능성이 아주 높음(DISEASE-MODIFYING)
12. 2016년 PDN 글로벌 시장은 PFIZER가 92.7% 차지하고 있지만 2026년에는 VM-202 DPN이 45.2% 이상 차지할 것으로 전망됨.
'바이오종목 > Helixmith(바이로메드)' 카테고리의 다른 글
| [포럼] 연구실이 創業전진기지가 돼야 한다 (0) | 2018.08.27 |
|---|---|
| Korean biotech buys GMP-ready production facility in California (0) | 2018.08.25 |
| 5 Korean biopharmaceuticals most active in P3 trials in 5 years (0) | 2018.08.24 |
| VIROMED미국 현지 법인 COO : Keith Hall (0) | 2018.08.22 |
| ViroMed Secures DNA Production Facility in the US (0) | 2018.08.21 |
글
5 Korean biopharmaceuticals most active in P3 trials in 5 years
설정
트랙백
댓글
http://www.koreabiomed.com/news/articleView.html?idxno=4016
More and more Korean pharmaceuticals are jumping into developing new drugs, raising the number of clinical trials done in Korea in the past five years.
 |
| Five Korean pharmaceuticals -- Viromed, Hanmi, Sillajen, Celltrion and Tego Science -- have been conducting phase 3 trials for their therapies. |
“More domestic pharmaceutical companies seem to be focusing on developing new drugs. The number of phase 1 and 2 trials is also increasing because Korea has been raising its competency regarding clinical trials,” said an official at Korea Research-based Pharma Industry Association (KRPIA).
“Globally, new drug development projects have decreased in number. Despite the drop, Korea has maintained its level relatively well in the number of clinical trials,” the official added.
Against this backdrop, some Korean pharmaceuticals have launched phase 3 trials. The five conducting important phase 3 trials include Viromed, Hanmi, SillaJen, Celltrion, and Tego Science.
Viromed
 |
Viromed has been busy with phase 3 trials for its plasmid DNA-based gene therapy, VM202. The drug contains hepatocyte growth factor (HGF) genes and has proven to be effective in regenerating peripheral nerves after neuronal injury as well as for diabetic neuropathy.
“When we injected VM202, it induced the production of various nerve regeneration factors and promoted Schwann cell division and migration,” the company said. “This ultimately increased the diameter of the nerve axon and the thickness of the myelin aqueduct.”
The firm was able to carry on its studies for VM202 after winning a patent fight with Reyon Pharmaceutical.
Related : Reyon’s suit against ViroMed dismissed over VM202 rights
The company is now conducting phase 3 trials in China with its Chinese partner Beijing Northland Biotech. The latter completed producing 500 liters of NL003, the Chinese version of VM202 that uses the same raw material called pCK-HGF-X7. The Chinese company completed phase 2 trial of NL003 and received approval from the China Food and Drug Administration to go ahead with the P3 trial in October last year.
Because plasmid DNA has yet to receive approval worldwide, establishing a mass production platform is mandatory for entering phase 3 trials and commercialization. While Beijing Northland has been working to do so in China over the past several years, Viromed said it also made strides in the U.S., securing a DNA production plant in San Diego, Calif.
“We are very pleased that the problem of production – which was the biggest variable – has been solved through the acquisition of the production facility,” ViroMed CEO Kim Sun-young said.
Hanmi Pharmaceutical
 |
Hanmi Pharmaceutical is nearing the clinical trial finish line regarding Rolontis, its low blood neutrophils treatment. Hanmi inked a deal with U.S.-based biotech Spectrum Pharmaceuticals to develop the bio-better of Amgen’s Neupogen.
Related : Hanmi’s development of immunotherapy agents goes as planned
Hanmi has used LAPSCOVERY (Long Acting Protein/Peptide Discovery Platform Technology) to reduce dosing frequency to once every three weeks. The firm presented clinical trials results for Rolontis at the 2018 American Society of Clinical Oncology (ASCO) conference in June, showing the therapy pitted against Neulasta was not inferior.
The company is processing through the pre-biologics license application (BLA) to win the approval by the fourth quarter of this year.
Sillajen
 |
Sillajen is rolling up its sleeves to conduct a phase 3 clinical trial on oncolytic virus therapy Pexa-Vec in China, according to industry sources.
The firm announced that it would recruit Chinese patients for a phase 3 study of Paxa-Vec via the China Drug Trial, a clinical trial information site run under the China FDA.
Sillajen’s trials are expected to take place at 24 hospitals in China, under the helm of Shukui Qin, deputy director of People's Liberation Army 81 Hospital in Nanjing. The drugmaker aims to gather 600 patients for the trials and has recruited 290 to date.
Related : SillaJen, Medytox one step closer to entering China
Sillajen plans to not only compare Pexa-Vec with Nexavar but secure data on combination therapy. Nexavar is known to be the only remedy for Chinese liver cancer patients.
If the company succeeds in commercializing Pexa-Vec, it will be able to get access to 200,000 patients in China, including those who have used Nexavar, Sillajen said.
The drugmaker aims to release Pexa-Vec in China in late 2020, after completing the trials and winning approval.
It also has phase 1 clinical trials underway for Pexa-Vec to treat solid cancer. According to Sillajen, the trial proved the safety and efficacy of Pexa-Vec on three patients with metastatic melanoma and five patients with liver metastasis colorectal cancer. The treatment also showed no severe side effects while also indicating a high tolerance among patients.
Celltrion
 |
Celltrion has been on a winning streak in expanding its biosimilar portfolio. The company is conducting phase 3 trials for biosimilars for AbbVie’s rheumatoid arthritis treatment Humira and Roche’s oncology therapy Avastin.
Celltrion is set to conduct global phase 3 clinical trials in about 75 sites in eight nations in the European region from August 2018. The company plans to complete phase 3 clinical trials by 2020.
After completing the clinical trials, Celltrion plans to maximize its market share in TNF-α inhibitor biosimilar markets under the strategy of diversifying its TNF-α inhibitors along with Remsima, which already owns 52 percent of Europe’s TNF-α inhibitor market, along with CT-P13 SC that is undergoing clinical trials with the goal of obtaining approvals in 2019.
Related : Celltrion to conduct clinical trials for its biosimilars
Celltrion has completed clinical trials for the safety and pharmacokinetic evaluation of CT-P16 in Korea last year. Recently, it has applied for phase 3 clinical trials in Portugal. Starting with Portugal, the company plans to apply for clinical trials sequentially to regulatory agencies in Europe, Latin America, and other countries, and will conduct phase 3 clinical trials for CT-P16 at about 150 sites in 20 countries.
Avastin, the original product of CT-P16, is an anticancer drug used for the treatment of metastatic colorectal cancer, metastatic breast cancer, non-small cell lung cancer and glioblastoma. The therapy recorded a sale of 7.5 trillion won ($6.6 billion) last year.
“Celltrion is proceeding smoothly with the planned schedule for CT-P16," a company official said. "CT-P16 plans to secure differentiated competitiveness compared its competitors."
Tego Science
 |
Tego has been making progress with its phase 3 trial for a rotator-cuff tear rejuvenation cell therapy dubbed the TPX-114. It applied for the Ministry of Food and Drug Safety’s sign-off on the clinical trial in February this year and got the approval a month later to go ahead with the trial.
Related : Tego applies for P3 clinical trials for tendon rejuvenation therapy
Rotator cuff tear refers to a tendon rupture that occurs due to excessive use or strong impact to the muscles or tendons in the shoulder area. The condition can cause musculoskeletal, cartilage and bone diseases.
TPX-114 is a treatment that injects the patient's fibroblasts into the ruptured tendons, which, in turn, induces the expression of the components of the tendon tissues and its growth factors. Ultimately, the treatment helps repair injured tendon tissues.
If approved, the drug will become the first cell-based therapeutic agent for tendon regeneration.
The company will conduct phase 3 clinical trials at the Seoul National University Hospital and Seoul National University Bundang Hospital.
“This year, we will speed up the development of various cellular therapeutic drug pipelines,” a company official said. “As soon as the company completes clinical trials of TPX-114, it plans to commercialize the treatment and lead the market for cell therapy products related to regenerative medicine such as rotator cuff and Achilles tendons.”
'바이오종목 > Helixmith(바이로메드)' 카테고리의 다른 글
| Korean biotech buys GMP-ready production facility in California (0) | 2018.08.25 |
|---|---|
| 바이로메드 8월 23일 ir 자료 - 네이버 와이티님 블로그 (0) | 2018.08.25 |
| VIROMED미국 현지 법인 COO : Keith Hall (0) | 2018.08.22 |
| ViroMed Secures DNA Production Facility in the US (0) | 2018.08.21 |
| '고무줄 회계' 연구개발비, '자산→비용' 처리 변화 (0) | 2018.08.18 |
글
대학교에서 MICROBIOLOGY 전공 MBA 전공...
VICAL에서 15년 이상 근무...
==============================================================
Executive with over 25 years of biopharmaceutical experience in Manufacturing, Quality, Process and Assay Development. Manage multi-departmental budgets and resources with a proven record of meeting project milestones, achieving corporate objectives, and managing costs within budget. Direct and manage operational activities related to drug substance and drug product production, in addition to CMC support for development and regulatory activities required for licensure of vaccine for the prevention of CMV reactivation in hematopoietic cell transplantation and solid organ transplants, and HSV-2 vaccine program.
경력 사항
Provide strategic leadership and operational oversight to the Manufacturing, Engineering, Validation, Quality Control and Assay Development groups.
Executive Team member responsible for corporate leadership, direction and strategic planning.• Responsible for leadership and oversight of Quality Control and Assay Development activities and budgets. Establish departmental goals, objectives, and operational metrics. Align objectives and functional area deliverables with corporate goals.
• Sr. Mgmt. representative on business development/partnership team. Provided Manufacturing and Quality leadership during partnership due diligence meetings. Provided technical overviews, address questions, and provided project related cost forecasts.
• Participate on cross-functional teams responsible for planning and process improvement activities (i.e., change control, quality, and manufacturing review boards).
• Design and implement quality systems, policies and practices compliant with all applicable laws and regulatory requirements (US, EU, Japan & ROW)
• Mentor and develop staff by providing and maintaining a collaborative work environment that is open and inclusive. Manage resources in accordance with company policies and procedures.
• Provide analytical and CMC regulatory support for client specific drug substance and drug product manufacturing projects.• Developed budget, project timelines and managed construction and start-up of Agennix’s recombinant human lactoferrin phase III/commercial manufacturing facility located in Capua Italy. Project completed on-time and $1 million under budget.
• Managed international project team responsible for process development, technology transfer to Capua facility, and manufacture of Recombinant Human Lactoferrin (rhLF) drug substance (DS).
• Evaluated, selected, and negotiated Fill/Finish CMO (Baxter, Patheon, Formatech), CTO (e.g., Lancaster, Nelson) and Materials Management (McKesson, Almac) contracts; managed contract activities
• Responsible for the CMC section of Agennix’s regulatory filings (e.g., FDA, EU/EMA, PMDA)
• Negotiated rhLF DS supply contracts and managed international corporate partnerships (Santen Pharmaceuticals, Meiji Pharma)
'바이오종목 > Helixmith(바이로메드)' 카테고리의 다른 글
| 바이로메드 8월 23일 ir 자료 - 네이버 와이티님 블로그 (0) | 2018.08.25 |
|---|---|
| 5 Korean biopharmaceuticals most active in P3 trials in 5 years (0) | 2018.08.24 |
| ViroMed Secures DNA Production Facility in the US (0) | 2018.08.21 |
| '고무줄 회계' 연구개발비, '자산→비용' 처리 변화 (0) | 2018.08.18 |
| 바이로메드 주담 통화 내용 (0) | 2018.08.18 |
글
ViroMed Secures DNA Production Facility in the US
설정
트랙백
댓글
https://markets.businessinsider.com/news/stocks/viromed-secures-dna-production-facility-in-the-us-1027470732
SEOUL, South Korea, Aug. 20, 2018 /PRNewswire/ -- ViroMed (084990:KS) announced its acquisition of a plasmid DNA production facility in San Diego, California from Vical Incorporated. With ViroMed's first Phase III clinical trial of its lead product VM202 (donaperminogene seltoplasmid) for painful diabetic peripheral neuropathy (PDPN) nearing its completion, ViroMed, in joint venture partnership with a private equity investment firm, acquired the GMP ready facility that has been until recently a production site for clinical studies including phase IIIs in the US of DNA-based investigational new drugs.
With CMC (Chemistry, Manufacturing, and Controls) being an important part of the Biologics License Application process, and often the reason for delay in market approval for a new drug in the US, the acquisition comes as a significant milestone for a company conducting late-stage development. Production is considered particularly an important issue in the case of plasmid DNA-based gene medicines as they have never been approved and commercialized as a drug for humans. Securing a manufacturing site is also expected to be a boost in the company's bargaining power for potential out-licensing and marketing partnership deals.
The facility in San Diego is equipped with a 500 L fermenter, cell culture lab and QC test lab, and has extra space for future expansion, making it an ideal site for both biopharmaceutical R&D and commercial-scale plasmid DNA production. With the aim to initiate first test runs within this year and GMP production in the first half of 2019, the company is securing key personnel necessary for the facility operation.
Anticipating the acquisition will add even greater value to the company and its lead product, CEO Sunyoung Kim, DPhil, commented, "We are very excited to secure a plasmid DNA production facility, which has been a major issue for the company. Through the acquisition, we expect to not only maximize the value of VM202 but also create additional business opportunities as we move forward. Taking a step further from an R&D-focused company, it is our vision to become a biopharmaceutical company in our own right that covers all stages of new drug development including R&D, production and quality management. ViroMed is currently the only company conducting Phase IIIs in the US involving plasmid DNA, and we are pleased to be able to demonstrate once again that ViroMed is a global leader in the field of plasmid DNA gene therapy."
About VM202
VM202, donaperminogene seltoplasmid, is a proprietary, non-viral, potentially regenerative plasmid DNA gene therapy. VM202 is a novel genomic cDNA hybrid human hepatocyte growth factor (HGF) gene with a novel and proprietary coding sequence (HGF-X7) expressing two isoforms needed for optimal therapeutic benefits. Because there is no change in the coding region of the HGF gene, HGF proteins generated from VM202 are identical to wild-type human HGF proteins.
When introduced into the body, HGF protein is expressed from VM202 and induces the formation of new blood vessels, suppresses levels of selective pain mediators, supports regeneration/repair of damaged peripheral nerves, and ameliorates atrophic condition of skeletal muscle.
About ViroMed Co., Ltd. and VM BioPharma
VM BioPharma is the US division of ViroMed Co., Ltd. which develops new and innovative biopharmaceuticals based upon its multiple proprietary scientific platform technologies to meet unmet medical needs. Currently, the company is actively focusing on developing its lead product, plasmid DNA-based drug VM202, at various clinical stages in the U.S., Korea, and China, for cardiovascular and neurological diseases, including PDPN, diabetic foot ulcer (DFU), amyotrophic lateral sclerosis (ALS) and ischemic heart disease (IHD). Visit viromed21.com.
Media Contact:
Debby Fireman
Fireworks
debby@fireworksbydesign.com
610.547.2229
Cathy Carroll, PhD, BSPharm
Director, Strategic Business Development
cathyc@viromed.co.kr
816.337.9962
Forward-Looking Statements
This press release contains forward-looking statements, which are generally statements that are not historical facts. Forward-looking statements can be identified by the words "expects," "anticipates," "believes," "intends," "estimates," "plans," "will," "outlook" and similar expressions. Forward-looking statements are based on management's current plans, estimates, assumptions, and projections, and speak only as of the date they are made. ViroMed undertakes no obligation to update any forward-looking statement considering new information or future events, except as otherwise required by law. Forward-looking statements involve inherent risks and uncertainties, most of which are difficult to predict and are generally beyond the control of the company. Actual results or outcomes may differ materially from those implied by the forward-looking statements because of the impact of a number of factors, many of which are made public in more detail through the company's corporate public announcement in compliance with the Financial Investment Services and Capital Markets Act of the Republic of Korea.These forward-looking statements represent the company's judgment as of the date of this release. The company disclaims, however, any intent or obligation to update these forward-looking statements.
View original content:http://www.prnewswire.com/news-releases/viromed-secures-dna-production-facility-in-the-us-300699394.html
SOURCE ViroMed
'바이오종목 > Helixmith(바이로메드)' 카테고리의 다른 글
| 5 Korean biopharmaceuticals most active in P3 trials in 5 years (0) | 2018.08.24 |
|---|---|
| VIROMED미국 현지 법인 COO : Keith Hall (0) | 2018.08.22 |
| '고무줄 회계' 연구개발비, '자산→비용' 처리 변화 (0) | 2018.08.18 |
| 바이로메드 주담 통화 내용 (0) | 2018.08.18 |
| 난치병 치료 유전자치료제 미래신약 주목…국내 임상만 67건 (0) | 2018.08.15 |
글
[데일리메디 양보혜 기자] 국내 바이오업체들이 연구개발비 자산화 기준을 변경하거나 비용 처리하는 등 회계 방식에 변화를 주고 있다. 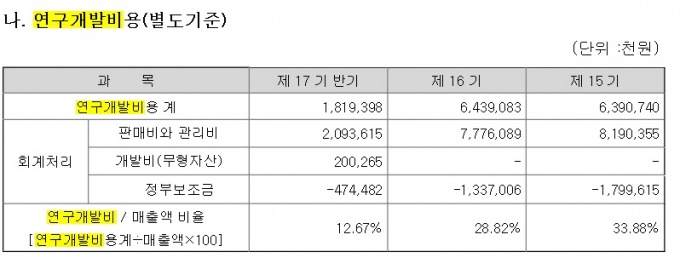 회사 측은 "연구개발비 전액을 비용으로 전환함으로써 자산화와 관련한 시장의 불확실성을 해소했다"고 강조했다. 메디포스트는 연구개발비 자산화 기준을 변경했다. 메디포스트는 "임상 3상 이후에 발생한 자출 중 정부의 승인 가능성이 높은 프로젝트만 무형자산으로 인식하고, 그 이전 단계에서 발생한 지출은 경상연구개발비로 여겨 당기 비용으로 처리하기로 했다"고 밝혔다. 새로운 기준이 적용되면서 1분기 연결기준 영업손실은 22원에서 33억원으로 감소했다. 오스코텍도 연구개발비를 무형자산으로 처리하던 기존 회계기준을 바꿨다. 올해 상반기 연구개발비 17억6500만원 중 100만원을 제외한 모든 지출을 비용처리한 것이다. 신약후보물질 발굴단계부터 자산 처리했던 관행에서 벗어나 임상 승인 이후부터 지출한 개발비 중 자산화 요건에 충족하는 지출만을 자산으로 여겨 지난해 영업손실이 16억원대에서 58억원으로 커졌다.
|
'바이오종목 > Helixmith(바이로메드)' 카테고리의 다른 글
| VIROMED미국 현지 법인 COO : Keith Hall (0) | 2018.08.22 |
|---|---|
| ViroMed Secures DNA Production Facility in the US (0) | 2018.08.21 |
| 바이로메드 주담 통화 내용 (0) | 2018.08.18 |
| 난치병 치료 유전자치료제 미래신약 주목…국내 임상만 67건 (0) | 2018.08.15 |
| 바이로메드, 당뇨병성 족부궤양 임상3상 연구자 회의 (0) | 2018.08.15 |
글
네이버 바이로메드 카페 화백님의 글 공유합니다..
주담 통화 공유합니다
1. 요즘 바메와 셀트가 공매의 주요 표적이
되고 있는듯하다. 연일 공매가 10%넘는데 주주로서 화가난다. 공매가 많은 이유중의 하나가 김대표님의
인터뷰도 영향이 있는거같다. 100%신약까지
3~4년 걸린다고 하니 기술이전은 없다는
시그널로 받아들여 맘껏 공매도 하는거 아닌가?
시장에 신뢰를 주는것은 좋은데 임상 진행과
관련된 사안은 진실되게 이야기해야지만 그렇지않은것은 시장의 반응까지 고려해 전략적으로 인터뷰해주시면 좋겠다. 이 내용을 김대표님께 말씀드려달라고 했습니다.
답변:주담분도 공매관련 일정부분 공감한다며
교수님께 기회를 봐서 말씀드리겠답니다.
2.DMD지정은 어떻게 되는 건지요?
여러 의견들과 혼선이 있다.
답변은 DMD는 FDA에서 지정하는게 아니라
FDA나 의사협회에서 신경재생치료제로서 인정하는거다
임상 결과가 나오고 DMD인정 여부가 정해질것이다
임상 2상까지 결과가 고무적이어서 현재 3-1상에서
신경재생 부분을 확인하려고 한다.
진통제로서 약가가 약 3만불, 신경재생효과가
있을경우 5만불정도, DMD지정되면 8만불정도
형성된다.(상당한 파급력이 있는거 같습니다)
3.DPN3-2상은 계획대로 하는것인가?
BLA는 어떻게 진행되는가?
네이버 종토방에서는 3-2상까지 끝나야
BLA허가 신청한다는 안티글들이 많이 올라온다
답변: 회사의 원래 계획은 3-1,2상을 다하는것이다
약의 효능에 대해서
FDA에서 극찬을 했지만 만성질환 유전자치료제로서
세계 최초의 신약이다보니 3-2상까지 계획한것이다
현재로서는FDA와 협의를 통해 3-2상은 할수도 안할수도
있지만 중요한것은 3-1상만으로 품목허가를
준비하고 신청할것이다(3-1상후 FDA와 협의하에
3-2상 관계없이 BLA 신청 예정)
4.PAD RMAT승인 신청은 언제 하는가?
답변: 김선영박사님이 이부분은 말씀을
안해주셨다. 그 이유는 DPN RMAT승인 신청시
여러곳에서 문의가 엄청 많았었다
회사 입장에서는 PAD가 돼도 좋고 안돼도
굳이 상관이 없는데
시장에서 받아들이는 파급효과는 매우크다
그래서 경영진에서 이야기를 안해주는거다
PAD RMAT 신청은 경영진에서 이미 했을수도
안했을수도 있다(상당히 묘한데요, 이미 했을
가능성도 있습니다)
5.유증한 자금으로는 내년까지 임상이 진행되면
고갈되는거 아닌가?
답변:VM202 임상까지 가능하다
그이후 추가 재원이 필요할경우는 경영진에서
대책을 마련할것이기 때문에 걱정하지 않아도 된다
여기까지가 주요내용입니다~^^
첨엔 제가 주가때문에 약간 흥분해서
이야기했는데 주담분이 인품이 훌륭하데요
진지하게 잘 받아주고 또 궁금한 사항도
성심껏 알러주었습니다
바쁠텐데도 오늘30여분 가까이
답변해주었습니다
오늘 다시 한번 느낀것은 지금은 비록 힘들더라도
곧 좋은 날들이 올것이고(소리소문없이 공매도를
파산시길겁니다) 큰 결실을 맺게 되리라는
생각이 들었습니다
모두 성투하시길 바랍니다
'바이오종목 > Helixmith(바이로메드)' 카테고리의 다른 글
| ViroMed Secures DNA Production Facility in the US (0) | 2018.08.21 |
|---|---|
| '고무줄 회계' 연구개발비, '자산→비용' 처리 변화 (0) | 2018.08.18 |
| 난치병 치료 유전자치료제 미래신약 주목…국내 임상만 67건 (0) | 2018.08.15 |
| 바이로메드, 당뇨병성 족부궤양 임상3상 연구자 회의 (0) | 2018.08.15 |
| 바이로메드, 샌디에고 생산시설의 풀가동을 위해 전문가들 본격 영입 (0) | 2018.08.14 |
글
코오롱생명과학 '인보사' 국내 첫 유전자 치료제 승인
난치성 질환 치료 유일한 대안으로 블록버스터 의약품 성장 기대
 |
| 【필라델피아(미 펜실베이니아주)=AP/뉴시스】미 펜실베이니아주 필라델피아의 필라델피아 아동병원에서 지난 10월4일 앨버트 매과이어 박사(오른쪽)가 미사 카발리(8)의 눈을 검사하고 있다. 미 식품의약국(FDA)은 19일(현지시간) 처음으로 유전자 변이로 인한 선천적 실명 환자에 대한 유전자 치료를 승인했다. 2017.12.20 |
【서울=뉴시스】류난영 기자 = 난치성 질환을 치료할 수 있는 유전자치료제가 글로벌 신약으로서의 가능성을 인정받으면서 '미래 신약'으로 주목 받고 있다.
유전자치료제는 질병의 예방이나 치료를 목적으로 환자의 세포나 조직에서 질환을 유발하는 비정상 유전자를 대체할 유전자나 질병을 치료하는데 도움이 되는 유전자를 삽입하는 치료기술을 뜻한다. 결핍·결함 유전자의 교정을 위해 기존의 유전자를 교정, 교체하거나 보충해 질병의 근본적인 문제 해결이 가능하다.
현대 의료기술의 한계로 치료가 어렵거나 불가능한 난치성질환 대부분과 암, 에이즈, 유전질환, 신경계질환 등을 유전자치료를 통해 치료할 수 있다.
15일 식품의약품안전처에 따르면 현재까지 전 세계적으로 허가된 유전자치료제는 성분명 기준으로 8건, 허가 품목 수 기준으로 10건에 불과하다.
기관별로는 유럽 EMA 4건, 미국 FDA 5건, 한국 1건으로 이 가운데 암젠의 악성흑색종 치료제 '임리직'이 유럽 EMA와 미국 FDA에 중복 허가를 받았다. 노바티스의 '킴리아'가 미국에서비 호지킨 림프종과 B세포 급성 림프구성 백혈병 등 두 개의 적응증으로 각각 허가를 받았다.
우리나라에서는 지난해 코오롱생명과학이 자체개발한 국내 최초의 골관절염 유전자치료제인 '인보사'가 식약처로부터 29번째 국산신약으로 허가받았다.
세계 최초로 개발된 유전자치료제는 2003년 시비오노 제네테크가 개발한 두경부암 유전자치료제 '젠다이신'으로 중국에서 승인됐다.
유럽에서 최초로 승인 받은 유전자치료제는 2012년 네덜란드의 유니큐어가 개발한 희귀 유전병인 지단백지질분해효소결핍증 치료제 '글리베라'다.
이후 3년간 추가 승인이 없다가 2015년 미국에서 암젠이 헤르페스 바이러스 유전자를 재조작해 만든 악성흑색종 치료제 '임리직'이 출시 허가를 받으면서 유전자치료제 분야에 대한 관심이 커지고 있다.
최근에는 미국 바이오기업인 스파크 테라퓨틱스가 개발중인 희귀 안구질환 유전성 망막형성장애 유전자치료제 'SPK-RPE65'가 임상 막바지 단계에 돌입했다.
유전자치료제는 난치병, 희귀질환 등도 치료할 수 있는 신약이라는 점에서 유전자치료제 시장이 빠른 속도로 성장하고 있다.
 |
세계적 시장조사 기관 얼라이드 마켓 리서치에 따르면 전세계 유전자치료제 시장은 2016년 5억8400만 달러(약 6584억원)에서 연평균 33.3%씩 성장해 2023년 44억200만 달러(약 5조원) 규모로 커질 것으로 예상된다. 특히 암질환과 희귀질환에 대한 유전자치료제가 전체시장의 60% 이상을 차지하며, 향후에도 가장 큰 시장을 형성할 것으로 전망된다.
세계유전자치료 임상시험에 따르면 지난해 기준으로 전 세계적으로 2463건의 유전자치료 임상시험이 진행되고 있다.
국내 기업들은 유전자치료제에 대한 임상 시험을 진행하는 등 유전자치료제 관련 시장을 선점하기 위해 뛰어들고 있다.
식품의약품안전처에 따르면 올해 상반기 기준으로 유전자치료제 임상시험 승인 건수는 67건으로 집계됐다.
이 가운데 바이로메드, 신라젠 등이 유전자치료제 임상 3상을 진행중이다.
신라젠이 개발 중인 간암 치료제 '펙사벡'은 현재 한국·미국·중국·프랑스·독일 등 16개국, 150여개 병원 600명의 환자를 대상으로 글로벌 임상 3상을 진행하고 있다.
펙사벡은 우두바이러스 유전자를 조작해 환자의 암세포만 감염시킨 후 체내 면역체계를 활성화하는 방식으로 암을 파괴하는 간암 치료제 후보물질이다.
바이로메드는 당뇨병성 신경병증 유전자치료제 'VM202-DPN'와 허혈성 지체질환 치료제 'VM202-PAD'의 미국 임상 3상을 진행중이다.
업계 관계자는 "난치성 질환을 앓고 있는 환자들은 유전자치료제 말고는 다른 대안이 없기 때문에 고가의 비용을 감수하더라도 유전자치료를 시도할 가능성이 높다"며 "멀지 않은 미래에 유전자치료제가 10대 블록버스터 의약품 목록에 들어갈 가능성이 충분히 있다"고 말했다.
'바이오종목 > Helixmith(바이로메드)' 카테고리의 다른 글
| '고무줄 회계' 연구개발비, '자산→비용' 처리 변화 (0) | 2018.08.18 |
|---|---|
| 바이로메드 주담 통화 내용 (0) | 2018.08.18 |
| 바이로메드, 당뇨병성 족부궤양 임상3상 연구자 회의 (0) | 2018.08.15 |
| 바이로메드, 샌디에고 생산시설의 풀가동을 위해 전문가들 본격 영입 (0) | 2018.08.14 |
| 바이로메드, HGF유전자의 신경재생 원리를 밝혀 국제학술지 게재 VM202의 disease modifying 능력을 입증 (0) | 2018.08.13 |












RECENT COMMENT