검색결과 리스트
글
네이버 카페에 올라온 정말 정리 잘 된 글입니다. 작성자에게 감사의 인사를...
===========================================
https://cafe.naver.com/viromed/10306
것을 알게되었습니다.
그래서 괜히 올렸다가 카페에 혼선을 주는건 아닌가 싶어 고민하다가 다양한 시각에서 검토와 의견 논의야 말로 집단지성의 발전이 아닐까 생각되어 용기내어 올려봅니다.
첫번째, 사례를 보기에 앞서 먼저 저희가 알아야할 것은 RMAT의 정의입니다.
지난 5/21일 회사 RMAT 공시를 보면, RMAT는 2016년 12월 탄생한 제도로 혜택으로 FDA가 시행중인 신속 개발 프로그램 중 패스트트랙(Fast Track)과 혁신의약품(Breakthrough therapy)의 혜택을 포함하고 있음 이라고 설명하고 있습니다.
즉, 이는 저희가 사례를 찾아볼 때 RMAT와 Fast track, BT까지 확장해서 보아야 한다는 것입니다.
두번째, 사례 검토 범위 확대와 제약에 대한 내용입니다.
RMAT는 분명 Fast Track, Breakthrough Therapy의 혜택을 포함합니다. 하지만 근본적으로 FDA가 정의하는 카테고리가 다르고 세부적인 차이가 있습니다. 그렇다면 여기에서 의문은 "과연 FT와 BT 사례를 보는것은 유의미한 것일까?" 라는 겁입니다. 저도 아직 확실한 답을 구하지 못했습니다.
2018년 7월 3일 기준 총 21개의 약물이 RMAT에 지정되어 있습니다. 또한 21개 약물은 각기 질환대상과 적응증이 다양합니다.
현재 제 결론은 "VM202와 유사Case는 있어도 동일Case는 없다. RMAT사례 분석으로 VM202의 기대 소요기간을 절대적으로 추정할 수 없다. 다만 다양한 사례를 통해 RMAT의 프로세싱과 FDA의 대응 속도 등에 대한 근본적인 팩트만 참고하자" 입니다.
RMAT, FT, BT 정의/비교에 대한 다양한 자료가 있지만 그냥 참고로 사진 두장을 올립니다.

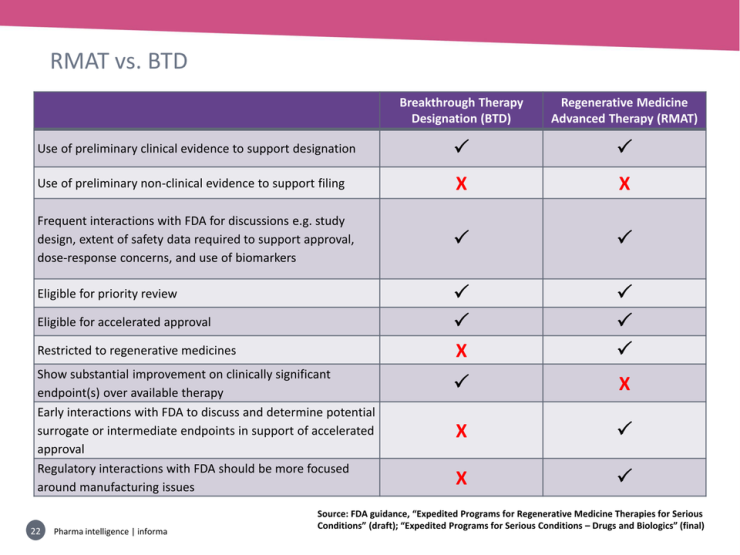
세번째, RMAT 사례 분석입니다.
먼저 RMAT 지정이 된 약물 중 Phase 3까지 진행된 것과 Phase 2까지 진행된 것을 구분하여 조사하고,
그외 카페를 통해 알게된 FT,BT 사례를 확인해보았습니다.
(지구력이 다하여 Phase 1에서 RMAT 받은것은 스킵하였습니다.)
아래 글은 제가 따로 노트에 메모한 내용인데 다소 보기 힘드시더라도 양해바랍니다.
여기에서 관심있게 모니터링 해야할 약물은 아래 내용에서 노란색으로 표시되어 있습니다.
==========================================================================================================
- RAMT 지정 약중 Phase 3의 약물들, VM202는 Phase3에 RAMT 지정 2018년 5월임
- Humacyte사의 humacyl (혈관계질환, 혈액투석을 위한 혈관확장 ) - Phase 3, RMAT 지정 2017/3월
- 최초의 RMAT지정, Breakthrough Therapy(2014) 와 RMAT(2017/3) 지정
- 2017년 9월 : 3상 환자모집 완료 (추적관찰 12개월)
- 2018년 3월 : Series C 투자 (75mil)
- 2018년 6월 : Fresenius Medical (세계 최대 투석/정맥영양공급 관련 제약회사) 와 150M에 판매권 파트너십 제휴
- 2019년 2월 : BLA신청??
- Mallinckrodt사의 StrataGraft (외상, 피부화상) - Phase 3, RMAT 지정 2017/7월
- 2018-08-04 : FDA meeting, BLA관련 기사 없음
- Kiadis사의 ATIR101 (암, 백혈병) - Phase 3, RMAT 지정 2017/9월
- 2018-04-13 : US 3상 진행중. 유럽출시는 2019년 1분기 기대
- we are currently conducting an international Phase III trial in which the first patient was enrolled in December 2017 as a basis for a subsequent FDA filing and marketing approval in the United States.
- We expect to obtain a Committee for Medicinal Products for Human Use, or CHMP, opinion in the fourth quarter of 2018 which, if positive, would enable us to receive a conditional marketing approval from the European Commission as early as the first quarter of 2019
- Bluebird Bio사의 LentiGlobin (유전질환, 악성 빈혈) - Phase 3, RMAT 지정 2017/10월
- 2018-08-04 : FDA meeting, BLA관련 기사 없음.
- Mesoblast사의 MPC-150-IM (심장질환, 진행성 심부전) - Phase 3, RMAT 지정 2017/12월
- 그럼 RAMT 지정 약중 Phase 2 의 약물들 진행은?
- Enzyvant사의 RVT-802 (유전질환, 디조지 증후군) - Phase 2, RMAT 지정 2017/4월
- Breakthrough Therapy와 RMAT 획득
- 2018-07-09 : FDA는 RVT-802에 대한 Rolling BLA 제출 프로세스에 동의. 회사는 2018말까지 BLA 승인완료를 기대함. https://www.prnewswire.com/news-releases/enzyvant-announces-initiation-of-rvt-802-rolling-bla-submission-for-the-treatment-of-complete-digeorge-anomaly-300677518.html
- Rolling BLA란? FDA의 특혜로 FT혹은 BT 지정받은 제품은 Rolling submission을 받을 수 있음. 예를 들어, 스폰서는 첫 번째 웨이브에서 비 임상 부분을 제출하고, 그 다음에 화학, 제조 및 제어 (CMC) 웨이브, 그리고 임상을 포함하는 최종 웨이브를 제출합니다. 또 다른 예로는 첫 번째 웨이브에서 CMC를 제출하고 마지막 웨이브에서 최종 안정성을 배치 할 수 있습니다. 본질적으로 신속함 -> 일반과 대조적으로 FDA가 예비 검토를 시작해야 한다는 것 http://theectdsummit.com/rolling-ectd-submissions-a-good-fit-for-expedited-fda-programs/
- jCyte사의 jCell (유전질환, 망막색소변성증) - Phase 2, RMAT지정 17년 5월
- 2018-08-04 : FDA meeting, BLA관련 기사 없음.
- Vericel사의 Ixmyelocel-T (심장질환, 확장성 심근병증) - Phase 2, RMAT지정 17년 5월
- 2018-08-04 : FDA meeting, BLA관련 기사 없음.
- Athersys사의 MultiStem(뇌혈관계질환, 허혈성 뇌졸증) - Phase 2, RMAT지정 17년 10월
- Fast track 및 RMAT지정.
- Juno사의 JCAR017 (암, 림프종) - Phase 2, RMAT지정 17년 11월
- 2018-01 : Celgene 사에 매각 $9 billion https://www.bloomberg.com/news/articles/2018-01-22/celgene-to-buy-juno-for-9-billion-signaling-cancer-aspirations
- 2018-08-04 : FDA meeting, BLA관련 기사 없음.
- Cellvation사의 CEVA101 (외상, 외상성 뇌손상) - Phase 2, RMAT지정 17년 11월
- 2018-08-04 : FDA meeting, BLA관련 기사 없음.
- Fast track 혹은 BT로 확장해서 사례를 살펴보면..
- Avexis의 AVXS-101, SMA(유전성 신경퇴행성 질환인 척수성 근위축) 치료제
- AVXS-101는 혁신치료제(Breakthrough Therapy)와 Type 1 SMA 환자를 대상으로 신속심사(Fast Track) 지정을 받음.
- 3상 진행 중 Type 1에 대해서 2020년3월 임상 완료 예정. 회사측에서 2018년 하반기 Pre-BLA 미팅, 2019년 약출시 목표.
- 03/05/2018 – AVEXIS INC – AVXS-101 PRE-BLA MEETING WITH FDA IS SCHEDULED TO BE HELD IN JUNE 2018 <2018-05-03>
- Novartis had a successful pre-BLA meeting with the FDA for AVXS-101 for the treatment of spinal muscular atrophy and a regulatory submission is expected in the second half of 2018. <2018-07-18 관련기사>
===================================================================
마지막으로 여기에서 저희가 관심을 가져야 할 내용입니다.
1. Enzyvant사의 RVT-802 : 2상진행중이며 2017년 4월 RMAT를 받았고 2018년 7월 FDA에 Rolling BLA 제출동의를 받아, 부분적인 Wave를 실시하고 있다는 것. 그리고 2018년 말까지 BLA 승인을 목표로한다는 것입니다.
즉, 2상에서 BLA승인 가능성. 그리고 VM202의 Rolling BLA 시도 등을 대입해 볼 수 있겠습니다.
2. Humacyte사의 humacyl : 3상진행중이며 2017년 9월에 환자모집 완료를 완료했다는 것.
즉 현 단계가 Follow-up(현재 12개월로 추정중)과정에 있다는 것과 RMAT가 있다는 것. 이는 바메와 가장 유사한 길을 걷는 사례라는 점입니다.
3. Avexis의 AVXS-101 : 3상 진행 중 2020년 3월 임상 완료 예정,회사측에서 2018년 하반기 Pre-BLA 미팅, 2019년 약출시 목표.
3상 종료전에 BLA 진행 과정과 FDA 반응은?
===========================================================================
두번째로 RMAT 승인된 Enzyvant 회사의 RVT-802 신약입니다.
2018.07.09,, 아마도 첫번째로 FDA로부터 <<롤링 BLA 제출 프로세스>> 동의를 획득했네요.
==> 제 구글링 실력으론 첫번째로 나옵니다만, 오류시 본문 글 수정하겠습니다.
아래 구글 번역에 나와 있듯이 올해 12월까지 BLA제출 완료를 목표로 한다고 합니다.
위 내용을 근거로 하면,, BLA의 총 소요기간은 10개월이였으나 RMAT 지정으로 6개월로 단축된다는
제도에 부합하는 내용이네요.
김선영교수님이 BLA를 위한 FDA 컨택을 올 9월에 시작한다고 말씀하셨는데,
아마도 하반기에 롤링 BLA 제출을 시작할 수 있으면,
아무리 늦어도 내년 중순쯤엔 BLA 종료를 선언할 수 있지 않을까 생각해 봅니다.
▶ 아래표에서 보시면, 17.4월 RMAT 지정 당시는 임상2상 중이였네요.
바이로메드는 당시 임상 3상이였으니 .. 바메도 BLA 시작할 때가 된거 같기도 하구요,,
RVT-802의 임상2상, 3상 시작시점과 끝을 아무리 구글링해도 못 찾겠네요. 회사 홈피에도 정보가 없구요, 힘드네요.
** 메리츠 이태영 자료 참조 (2018. 7. 16)
▶ BLA 제출 시작 기사 - 18년 7월 9일
Enzyvant Announces Initiation of RVT-802 Rolling BLA Submission for the Treatment of Complete DiGeorge Anomaly
Rolling BLA submission has been agreed to by FDA and is intended to expedite the Agency's review process
Completion of rolling BLA submission anticipated by end of 2018
RVT-802 has been awarded Breakthrough Therapy and RMAT designations, as well as pediatric rare disease and orphan designations
Enzyvant to present at Roivant Pipeline Day on July 10
<<헤드라인 번역>>
Enzyvant, 완벽한 DiGeorge Anomaly 치료를위한 RVT-802 Rolling BLA 제출 개시
롤링 BLA 제출은 FDA의 동의를 받았으며 식품 기준 청의 검토 절차를 신속히 진행할 예정입니다.
2018 년 말로 예상되는 롤링 BLA 제출 완료
RVT-802는 소아용 희귀병 및 고아 지정뿐만 아니라 Breakthrough Therapy 및 RMAT 지정을 받았습니다.
7 월 10 일 Roivant Pipeline Day에서 발표 할 Enzyvant
===============================================================
<< 본문 구글 해석>>
희귀 질환 환자를위한 혁신적인 치료제 개발에 주력하는 바이오 제약 회사 Enzyvant는 RVT-802를위한 생물학적 허가 신청서 (BLA)의 롤링 제출을 오늘 시작했다고 발표했다. 미국 식품의 약국 (FDA)에 제출해야합니다. 회사는 2018 년 말까지 BLA 제출을 완료 할 것으로 예상됩니다.
RVT-802는 완전한 DiGeorge Anomaly (cDGA)와 관련된 선천적 인 athymia로 인한 초기 면역 결핍을 치료하기 위해 고안된 연구, 조직 기반 재생 치료법입니다. RVT-802는 환자의 평생 동안 한 번만 관리하도록 설계되었습니다. cDGA는 치료를받지 않으면 균일하게 치명적이며, 감염의 감수성으로 인해 생후 24 개월 이내에 전형적으로 사망합니다.
RVT-802에는 획기적인 치료 지정, 재생 의학 고급 치료 (RMAT) 지정, 드문 소아 질환 지정 및 FDA의 고아 약 지정이 부여되었습니다. 높은 충족되지 않은 의료 요구를 해결하고자하는 FDA의 노력의 일환으로 FDA는 RVT-802에 대한 롤링 BLA 제출 프로세스에 동의했다.
엔 지탱 트 (Enzyvant)의 알빈 쉬 (Alvin Shih) 최고 경영자는 "우리는 RVT-802 BLA 제출을 시작하게되어 매우 기쁘게 생각합니다. 이것은 엔 자당 트의 경우뿐만 아니라 cDGA 및 그 가족의 영아에게도 중요한 이정표가되었습니다. "이 혁신적인 프로그램을 추진하기 위해 끊임없이 노력한 팀 전체에 감사드립니다. 우리는 2018 년에 BLA를 완수하여 EPA가 철저하고시기 적절한 검토를 할 수 있도록 계속 목표를 추진할 것입니다."
Shih 박사는 내일 오후 7 시부 터 오후 5시에 뉴욕시의 Roivant Pipeline Day에서 발표 할 예정입니다.
Roivant Sciences의 설립자이자 CEO 인 Vivek Ramaswamy는 "이 치명적인 상태로 고통받는 환자의 삶을 개선하기위한 Enzyvant의 헌신을 자랑스럽게 생각합니다. "로이 반트의 성공에 대한 궁극적 인 기준은 심각한 질병으로 고통받는 환자들에게 진정으로 혁신적인 치료법을 제공하는 것입니다. 오늘 발표는 우리 회사의 역사에서 중요한 이정표가되었습니다."
DiGeorge Anomaly의 완벽한 완성
완전한 DiGeorge Anomaly (cDGA)는 미국에서 매년 출생 한 신생아 약 10 만 ~ 20 만 명 중 약 1 명에 영향을 미치는 희귀 질환입니다. cDGA를 가진 어린이는 흉선없이 태어나서 정상적인 기능을하는 T 세포를 생성 할 수 없기 때문에 심한 면역 결핍을 초래합니다. T 세포는 감염을 막고 면역계의 필수 과정을 조절합니다. cDGA는 치료를받지 않으면 균일하게 치명적이며, 감염의 감수성으로 인해 생후 24 개월 이내에 전형적으로 사망합니다.
RVT-802 정보
RVT-802는 cDGA와 관련된 선천적 인 athymia로 인한 1 차 면역 결핍을 치료하기 위해 고안된 연구 조직 기반 재생 치료입니다. RVT-802는 조사 중이며 현재 FDA 또는 기타 건강 관리 기관에서 상업적 용도로 승인하지 않았습니다.
Enzyvant 정보
Enzyvant는 희귀 질환 환자를위한 혁신적인 치료법 개발에 주력하는 생물 약제 회사입니다. Enzyvant는 Duke 대학과 공동으로 DiGeorge Anomaly와 관련된 원발 면역 결핍 치료를위한 연구 조직 기반 치료법 인 RVT-802의 개발을 진전시키고 있습니다.
Enzyvant는 Farber 질환 치료를위한 연구용 효소 대체 요법 인 RVT-801의 임상 시험을 동시에 시작할 준비를하고 있습니다. Enzyvant는 높은 희귀병이 필요한 추가 희귀 질병 치료법을 개발할 계획입니다.
▶ RMAT 획득 기사 - 17년 4월 17일
Enzyvant Receives FDA Breakthrough Therapy Designation and Regenerative Medicine Advanced Therapy Designation for Investigational Therapy RVT-802
===================================
<< 본문 구글 해석>>
- RVT-802는 DiGeorge 증후군 완전 치료를위한 임상 적 생물학적 요법으로 치료받지 않으면 희귀 한 소아 질환입니다.
- RVT-802는 RMAT 지정을받는 최초의 치료 요법 중 하나입니다.
- Enzyvant, 2018 년 상반기 BLA 제출 가능성 예상
희귀 질환 환자를위한 혁신적인 치료제 개발에 주력하는 바이오 제약 회사 Enzyvant는 미국 식품의 약국 (FDA)이 Enzyvant의 연구 조직인 RVT-802를 부여했다고 발표했다. (DiGeorge Syndrome) 치료법, 획기적인 치료법 지정 및 재생 의학 고급 치료법 (RMAT) 지정을위한 기초 요법입니다. 두 지정 모두 개발 지침 및 신속 검토 경로를 위해 조직 및 고급 치료 사무소에 대한 특별 액세스 권한을 부여합니다.
"우리는 RVT-802가 획기적인 치료법 지정을 받았다는 것을 기쁘게 생각하며 RMAT 지정을받는 첫 번째 프로그램 중 하나임을 영광으로 생각합니다."라고 Enzyvant의 Alvin Shih 최고 경영자는 전하면서, "우리는 치료 후보 RVT-802를 가능한 한 신속하고 책임감있게 cDGS 환자에게 제공 할 수 있도록 FDA와 긴밀히 협력하기를 기대합니다."
Duke 대학의 소아과 교수이자 RVT-802의 발명가 인 M. Louise Markert 박사는 "오늘의 발표는 앞으로 DiGeorge가있는 어린이들이 잠재적으로 생명을 구하는이 치료법에 적시에 액세스 할 수 있기를 희망합니다.
Roivant Sciences의 설립자이자 CEO 인 Vivek Ramaswamy는 "Roivant 가족 전체를 대표하여 우리는 유망한 치료를위한이 획기적인 이정표를 자랑스럽게 생각합니다. "이것은 우리 팀에게는 중요한 순간이며,이 끔찍한 질병에 직면 한 가족에게는 가장 중요합니다. 우리는 희귀 질환으로 고통받는 환자에게 RVT-802 및 기타 잠재적 인 변형 치료법을 제공하겠다는 임무에서 Enzyvant를 지원하기를 기대합니다. "
획기적인 치료법 지정은 심각한 또는 생명을 위협하는 상태의 약물 개발 및 검토를 신속하게하기위한 것입니다. 그러한 지정 기준에는 약물이 유효 치료법보다 임상 적으로 의미있는 하나 이상의 종점에서 실질적 개선이있을 수 있다는 예비 임상 증거가 포함됩니다.
RMAT 지정은 2016 년 12 월에 법으로 서명 된 21 세기 치료법의 구성 요소입니다. 적격 약물에는 세포 요법, 치료 조직 공학 제품, 인간 세포 및 조직 제품 또는 이러한 요법 또는 제품을 사용하는 복합 제품이 포함됩니다. 이 자격을 얻으려면 자격이되는 약품이 심각하거나 생명을 위협하는 질병이나 상태를 치료, 수정, 역전 시키거나 치료해야하며, 그러한 질병에 대한 충족되지 않은 의학적 필요를 해결할 잠재력이 있음을 나타내는 예비 임상 증거가 있어야합니다. 조건.
================
Enzyvant is the second company to announce the receipt of RMAT designation for an investigational drug and the first to announce the simultaneous receipt of RMAT and Breakthrough Therapy designations.
Enzyvant는 rmat 지정을 받은 두 번째 회사이자 rmat와 BT를 동시에 수령한 첫 번째 회사이다.
=================
완벽한 DiGeorge 증후군에 관하여
완전한 DiGeorge Syndrome (cDGS)은 선천적 인 DiGeorge 증후군 환자의 약 1 %를 차지합니다. cDGS의 세 가지 주요 특징은 선천성 심장병, 부갑상선 기능 항진증 (낮은 칼슘 수치로 이어진다), 및 athymia (흉선 조직 부족)입니다. 아티 미아는 정상적인 기능을하는 T 세포를 생산할 수 없기 때문에 심한 면역 결핍을 초래합니다. T 세포는 감염을 막고 면역계의 필수 과정을 조절합니다. cDGS는 치료를받지 않으면 균일하게 치명적이며, 감염에 대한 감수성으로 인해 일반적으로 생후 2 년 이내에 사망합니다.
RVT-802 정보
RVT-802는 cDGS로 인한 원발성 면역 결핍 치료를 위해 동종 흉선 조직을 채취, 배양 및 적용하기 위해 독점적 인 프로세스를 사용하는 연구 용 생물학적 요법입니다. 예비 임상 결과는 치료받은 환자의 생존율이 70 %를 넘는 것으로 나타났습니다. 획기적인 치료 지정 및 재생 의학 고급 치료 지정 외에도 RVT-802에는 FDA의 고아 약 지정이 부여되었습니다. Enzyvant는 2018 년 상반기에 BLA를 제출할 것으로 예상하고 있습니다. RVT-802는 현재 임상 시험 중이며 FDA 또는 기타 건강 관리 기관에서 상업적 용도로ㅁ 승인하지 않았습니다.
'바이오종목 > Helixmith(바이로메드)' 카테고리의 다른 글
| 바이로메드 "中 노스랜드, 3상용 VM202 대량 확보" (0) | 2018.08.07 |
|---|---|
| 김선영 바이로메드 대표 "美 생산시설 인수...'VM202' 상용화 8부능선 넘었다" 출처 : http://www.sedaily.com/NewsView/1S38RQ8JV1 (0) | 2018.08.05 |
| 바이로메드, 김선영 단독 대표이사 체제로 전환 "VM202 임상 3상 종료 앞두고 변화 필요성" (0) | 2018.08.03 |
| 매일경제 2015년 김선영 박사 인터뷰 (0) | 2018.08.02 |
| 바이로메드, 김선영 1인 대표이사 체제로 전환 (0) | 2018.08.01 |


RECENT COMMENT