 Sunyoung Kim, CEO and founder of ViroMed, reveals his strategy for conquering the US market and the feasibility of his ambitions for ViroMed to become the biotech company with the largest revenues from gene therapy by 2025. He also discusses the areas within the Korean biotech sphere that must develop to truly entrench the country as a dominant player in the global market.
Sunyoung Kim, CEO and founder of ViroMed, reveals his strategy for conquering the US market and the feasibility of his ambitions for ViroMed to become the biotech company with the largest revenues from gene therapy by 2025. He also discusses the areas within the Korean biotech sphere that must develop to truly entrench the country as a dominant player in the global market.
In short, our technology and disease platforms allow us to develop a number of different products and to target many different diseases
ViroMed differs from many biotech ventures in that it has a much wider focus of operations. What led you to take this more unorthodox approach?
After founding the company, my strategy has always been to develop platforms for technologies and target indications. The majority of start-ups and small biotech companies like ours are generally built around only a single product or a single technology. When this fails, the company collapses. Furthermore, at the time of founding the company in 1996, the term “biotech venture” was new to the Korean investor community, even amongst venture capitalists, and, not surprisingly, the investors were conservative and reluctant in risk-taking. Therefore, I had a strong need to minimise the level of business risk while maximising investment opportunities by focusing on developing multiple technology platforms.
With our scientific and technological platforms in place, we established a conceptual disease platform, where we work on a variety of target diseases that have similar underlying pathologies, instead of one disease in isolation. This way, we can use similar techniques and methodologies for research and experiments. For example, the protein produced from intramuscularly injected VM202, one of our flagship gene medicines, can interact with endothelial cells and smooth muscles cells to make new blood vessels, and also can interact with muscles and neurons to improve pathologic conditions and symptoms. Using these effects, we have been conducting clinical trials for four different diseases using one product, in this case, VM202. This is what I call the disease platform.
In short, our technology and disease platforms allow us to develop a number of different products and to target many different diseases. As such, our R&D programs are run very cost-effectively and swiftly.
How has ViroMed maintained the financing required for its operations throughout the development stages?
Based on my experience, it takes about 15 years and at least USD 200 million (excluding pre-launch related expenses) for one product to get BLA approval after one or two Phase III studies. A majority of the money, say about 85 percent, seems to have been spent during the last three years.
In the case of VM202, it will take 20 years, assuming we obtain BLA approval in the year 2020, and that is because we just did not have enough resources to push forward according to our schedule. The first nine years following our inception saw investment coming from venture capitalists and institutional investors. From 2006, after the company went public, we were able to raise capital through the stock market.
Meanwhile, being a company developing a variety of new drugs, ViroMed was barely able to generate meaningful revenues and thus had to stay in the red virtually every year. Thankfully, however, we have continued to receive investments over the past 12 years and ViroMed is probably the first company of this kind in both the KOPSI and the KOSDAQ. I believe this was possible for a number of reasons. Firstly, we were undertaking something genuinely meaningful, developing the world’s first gene medicines in several different disease areas. Secondly, I was able to convince investors by presenting the significance and the scientific, clinical, and commercial potential of our products. Finally, we fulfilled the promises made to our investors by progressing and delivering results. For these reasons, our credentials have been quite strong in the public market, which is often not the case for many small biotech firms.
This year you set up a legal entity in the USA and acquired a production facility in San Diego. What made now the right time for overseas expansion?
It was a natural evolution for the company. Based on our experience, we had reasons to be optimistic about the outcome of the phase III trial that will conclude next summer, and we had to be prepared for commercial-scale manufacturing. The first product is made of plasmid DNA. Plasmid DNA has never been commercialised as a medicine for humans. Most of the contract manufacturing organizations we have worked with thus far for our clinical studies are not large enough for commercial supply, and the production cost and schedule have always been challenging. For months I searched for manufacturing sites across the world, eventually finding a production site in San Diego. This site already had experience in producing phase III DNA, so we acquired the asset and established an entity called Genopis Inc.
I am planning to utilize this facility not only as our commercial production site for our first plasmid DNA product but also as a CMO for other biotech companies. This site will also become home to ViroMed-USA, the HQ for our North America operations and also possibly provide an incubator function for other early-stage biotech companies in the US and Korea.
In terms of your flagship platform VM202, could you give our readers an overview of the progress and timeline of this project?
VM202 can target a wide range of indications in the area of neurological and cardiovascular diseases. Initially, we are conducting clinical studies for painful diabetic peripheral neuropathy (PDPN), amyotrophic lateral sclerosis (ALS), diabetic foot ulcer (DFU), and myocardial infarction. For PDPN, the first readout from phase III will be available next summer.
There are huge unmet medical needs for all of these four diseases. For example, regarding PDPN, only a couple of prescription drugs are available to patients, of whom only around 50 percent can use the medications. Our phase I and II studies for PDPN indicated that VM202 is very safe, showing virtually no drug-related adverse effects. Most importantly, our data reveals that VM202 works even more effectively in patients who do not currently use available PDPN medicines like gabapentin or pregabalin. The implications are obvious: VM202 will provide hope to those patients suffering from pain that is unbearable. Looking at the list of phase II and III clinical trials being conducted for PDPN, I can hardly see potential competitors over the next 7-10 years as all of them are using candidate medicines based on small molecules aiming at just pain reduction.
The results from this ongoing phase III will be made publicly available between June and August 2019. We hope to bring this product to the market in the year 2020 to 2021, and to capture at least 10 percent of an estimated 1.8 million chronic PDPN patients in the US alone. While we base our clinical trials in the United States given our ambitions to establish ourselves there, the world’s largest pharmaceutical market, we plan to do bridging studies in other territories such as EU and Japan once the market approval is obtained in the US.
Being the third largest market in Asia, Korea constitutes only two percent of the global market and thus operating only in the Korean market could barely recoup the USD 300 million already spent on VM202 development. Moreover, meeting the US regulations and launching our product there will provide a springboard to enter the European and Japanese markets at a later date.
Where are the main shortcomings within the Korean market?
The pharmaceutical market in Korea is small relative to the amount of money that we have to invest in the development of a new drug. Secondly, Korean physicians are highly skilled at following well-established protocols, but very conservative in the case of novel concepts and new approaches that may require designing new protocols and new endpoints or parameters. In addition, for this type of innovative medicine, Korea’s regulatory agency also becomes highly restrictive, asking to address various sorts of hypothetical issues and situations. Therefore, for truly new and innovative drugs, we do proof-of-concept studies in the US, and then find a local partner in Korea for marketing there.
What can be done so that Korean biotech can make breakthrough discoveries and inventions in pharmaceutical areas?
Korea should take two approaches. The first is an in-house approach, that is, nurturing and using made-in-Korea sciences and technologies. Given the short history of science and start-ups in Korea as well as the relatively small size of the venture companies, I reason that Korean ventures have performed relatively well. ViroMed is a good example. Looking around, I see great potential with Korean universities. I hope that the Korean government more aggressively promotes start-ups by providing them with appropriate legal and financial infrastructure. There is two type of start-ups; those established by university faculty members and their associates or those by people who have left their jobs to set up their own business. I see great potential in the former case. The only bottleneck is the conservative academic culture which resists any changes in the traditional roles of the university.
The second approach is the use of technologies developed in other countries like the US or Japan or European countries. The size of the R&D budget in Korea is small. To make matters worse, the budget execution is poorly managed by bureaucrats and amateurish academics. Thus, the potential for producing truly meaningful discoveries and inventions in Korea is slim.
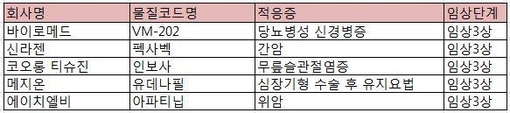
However, Korean scientists are very good at converting early-stage technologies developed overseas into tangible products. This approach is already being undertaken. Many remain unaware that recently highlighted two gene medicines from Kolon Life Science and SillaJen are actually foreign-born products. Kolon’s allogeneic cell/gene therapy product, Invossa was originally developed by TissueGene founded by a Korean-American scientist in the US, while SillaJen’s oncolytic vaccinia virus was originally developed by North American scientists and their company. Kolon and Shillagen brought these products into Korea’s financial market, secured money from Korea’s stock market, and conducted their phase III trials. I have long advocated this approach, but the patriotic or nationalist culture of Korea does facilitate this.
You are striving to become the biotech company with the largest revenues from gene therapy by 2025. How realistic do you believe this goal is?
We hope to achieve this by 2023, even sooner than the 2025 target. This is dependent on when VM202 is going to enter the market. Last year, we asked an outside consulting firm for an estimated drug price and market size for PDPN, who suggested that given the medical need and seriousness of the disease, VM202 can begin to generate USD 10 billion-plus revenue from the fifth year after market entry. The revenue will continue to grow till until plateauing several years later. This is only for the PDPN indication in the US market. Although merely an assumption, it is consistent with estimates by other independent sources. For example, GlobalData based in London also reported that by 2026, more than 45 percent of the global PDPN market might be captured by VM202.
There are 23 candidates listed in phase III. Almost all of them treat rare genetic diseases and quite restricted cases of cancers that are markets limited in size. Therefore, I am comfortable with my goal of having the world’s best-selling gene medicine.
==================================
ViroMed는 운영에 훨씬 더 광범위한 초점을 가지고 있다는 점에서 많은 생명공학 벤처와 다르다. 왜 더 비정통적인 접근을 하게 되었나요?
회사를 설립하고 나서, 저의 전략은 항상 기술과 목표지시를 위한 플랫폼을 개발하는 것이었습니다. 우리 회사 같은 신생 기업이나 소규모 생명공학 회사들의 대다수는 일반적으로 단일 제품이나 단일 기술을 중심으로 만들어진다. 이것이 실패하면 그 회사는 파산한다. 게다가 1996년 설립 당시 벤처 투자가들 사이에서도 생명공학 벤처라는 용어는 한국 투자자들에게도 처음이었으며, 당연히 투자자들은 보수적이고 위험 감수하기를 꺼렸다. 따라서 여러 기술 플랫폼을 개발함으로써 투자 기회를 극대화하는 동시에 비즈니스 리스크 수준을 최소화해야 했습니다.
우리의 과학적, 기술적 플랫폼을 갖추면서, 우리는 하나의 질병 대신 유사한 병리학을 가진 다양한 표적 질병들을 연구하기 위한 개념적 질병 플랫폼을 구축했습니다. 이런 식으로, 우리는 연구와 실험을 위해 비슷한 기술과 방법론을 사용할 수 있다. 예를 들어, 우리의 대표적인 유전자 약 중 하나인 VM202에서 생성된 단백질은 새로운 혈관을 만들기 위해 내피세포와 매끄러운 근육세포와 상호작용할 수 있으며, 또한 근육과 뉴런과 상호작용을 하여 근육과 뉴런을 향상시킬 수 있다. 이러한 효과를 사용하여, 우리는 하나의 제품인 VM202를 사용하여 네 가지 질병에 대한 임상 실험을 수행해 왔습니다. 이것이 제가 질병 플랫폼이라고 부르는 것입니다.
간단히 말해서, 우리의 기술과 질병 플랫폼은 우리가 다양한 제품을 개발하고 많은 다른 질병을 목표로 삼을 수 있게 해준다. 따라서, 당사의 R&D 프로그램은 매우 비용 효율적이고 신속하게 운영됩니다.
ViroMed는 개발 단계 내내 운영에 필요한 자금을 어떻게 유지했습니까?
제 경험에 비추어 볼 때, 한 제품이 1단계 또는 2단계 연구 후 BLA 승인을 받으려면 약 15년, 최소 2억 달러(약 2억 달러)가 필요합니다. 약 85퍼센트가 지난 3년 동안 사용된 것으로 보인다.
VM202의 경우 2020년에 BLA 승인을 받는다면 20년이 걸릴 것입니다. 이는 일정에 따라 추진할 리소스가 충분하지 않았기 때문입니다. 창업 후 처음 9년 동안은 벤처 투자가와 기관 투자가들로부터 투자가 이루어졌습니다. 회사가 상장된 후인 2006년부터 우리는 주식시장을 통해 자본을 조달할 수 있었다.
한편, 다양한 신약을 개발하는 회사로서, ViroMed는 의미 있는 수익을 낼 수 거의 없었고, 따라서 사실상 매년 적자를 유지해야 했다. 하지만 감사하게도 우리는 지난 12년 동안 계속해서 투자를 받아왔고, 비로메드는 아마도 KOPSI와 코스닥 둘 다에서 이런 종류의 회사 중 최초의 회사일 것이다. 나는 이것이 여러 가지 이유로 가능하다고 믿는다. 첫째, 우리는 몇몇 다른 질병 분야에서 세계 최초의 유전자 약을 개발하면서 진정으로 의미 있는 일을 하고 있었습니다. 둘째로, 저는 우리 제품의 중요성과 과학적, 임상적, 상업적 가능성을 제시함으로써 투자자들을 설득할 수 있었습니다. 마지막으로, 우리는 진행과 결과 전달을 통해 투자자들에게 한 약속을 이행했습니다. 이러한 이유로, 우리의 자격 증명은 공공 시장에서 꽤 강해졌는데, 이것은 종종 많은 소규모 생명공학 회사들에게는 해당되지 않는다.
올해 당신은 미국에 합법적인 단체를 설립하고 샌디에고에 생산 시설을 인수했습니다. 무엇이 지금이 해외 확장을 위한 적기였는가?
그것은 그 회사에 있어서 자연스러운 발전이었다. 우리의 경험을 바탕으로, 우리는 내년 여름에 끝날 3단계 재판의 결과에 대해 낙관할 이유가 있었고, 우리는 상업적인 규모의 제조에 대비해야 했다. 첫 번째 제품은 플라스미드 DNA로 만들어진다. 플라스미드 DNA는 인간을 위한 약으로 상업화 된 적이 없다. 지금까지 임상 연구를 위해 협력해 온 대부분의 계약 제조 조직은 상업적 공급을 위해 충분히 크지 않으며 생산 비용과 일정은 항상 까다로웠습니다. 몇 달 동안 저는 전 세계의 제조 현장을 찾았고, 결국 샌디에이고에서 생산지를 찾았습니다. 이 사이트는 이미 3단계 DNA를 생산한 경험이 있기 때문에 우리는 자산을 인수하여 Genopis Inc.라는 단체를 설립했다.
저는 이 시설을 우리의 첫 번째 플라스미드 DNA 제품의 상업적인 생산 현장뿐만 아니라 다른 생명공학 회사들의 CMO로도 활용할 계획입니다. 이 사이트는 또한 북미 사업부의 HQ인 ViroMed-USA의 본거지일 뿐만 아니라 미국과 한국의 다른 초기 생명공학 회사들에게 인큐베이터 기능을 제공할 수도 있습니다.
귀사의 대표 플랫폼인 VM202에 관해 독자들에게 이 프로젝트의 진행 상황과 일정에 대해 간략하게 설명해 주시겠습니까?
VM202는 신경 및 심혈관 질환 분야에서 광범위한 징후를 목표로 삼을 수 있다. 처음에 우리는 고통스런 당뇨병 말초 신경병(PDPN), 근위축성 측색경화증, 당뇨병 발 궤양(DFU), 심근경색을 위한 임상연구를 실시하고 있다. PDPN의 경우, 3단계에서의 첫 번째 판독이 내년 여름에 가능할 것이다.
이 네 가지 질병 모두에 대해 충족되지 않은 의학적 요구가 있다. 예를 들어, PDPN과 관련하여, 약 50%만이 이 약을 사용할 수 있는 환자에게는 단지 몇 개의 처방약만이 이용 가능하다. PDPN에 대한 1단계 및 2단계 연구 결과에 따르면 VM202는 매우 안전하며 약물 관련 부작용은 거의 없습니다. 가장 중요한 것은 VM202가 현재 Gabapentin 또는 Pregabalin과 같은 사용 가능한 PDPN 약을 사용하지 않는 환자에게 훨씬 더 효과적으로 작동한다는 것입니다. 그 의미는 분명하다: VM202는 참을 수 없는 고통으로 고통 받는 환자들에게 희망을 줄 것이다. PDPN을 위해 시행되는 2단계와 3단계 임상시험의 목록을 보면, 나는 향후 7-10년 동안 잠재적 경쟁자들을 거의 볼 수 없다. 왜냐하면 그들 모두가 단지 통증 완화를 목표로 하는 작은 분자를 기반으로 하는 후보 의약품을 사용하기 때문이다.
현재 진행 중인 3단계의 결과는 2019년 6월부터 8월까지 공개된다. 우리는 이 제품을 2020년에서 2021년까지 시장에 내놓고 미국에만 약 180만 명의 만성 PDPN 환자 중 적어도 10%를 차지할 수 있기를 희망한다. 세계 최대의 제약시장인 미국에 자리매김하고자 하는 우리의 야망을 감안하여 미국에서 임상실험을 하는 동안, 우리는 미국에서 시장승인이 이루어지면 EU와 일본 같은 다른 지역에서 상호연구를 할 계획이다.
아시아에서 세 번째로 큰 시장인 한국은 세계 시장의 2%밖에 차지하지 않아 한국 시장만 운영하면 이미 VM202 개발에 들어간 3억 달러를 거의 회수할 수 없었다. 게다가, 미국의 규제를 충족하고 그곳에서 우리의 제품을 출시하는 것은 훗날 유럽과 일본 시장에 진출할 수 있는 발판을 제공할 것이다.
한국 시장의 주요 단점은 무엇입니까?
한국의 제약시장은 우리가 신약 개발에 투자해야 하는 돈의 양에 비해 작다. 둘째로, 한국의 의사들은 확립된 프로토콜을 따르는 데 매우 능숙하지만, 새로운 개념과 새로운 접근법의 경우 새로운 프로토콜과 새로운 종말점 또는 매개변수를 설계해야 할 경우 매우 보수적이다. 게다가, 이런 유형의 혁신적인 의약품의 경우, 한국의 규제 기관 역시 매우 제한적이 되어, 다양한 종류의 가상의 문제와 상황을 다루기를 요구한다. 따라서, 우리는 정말 새롭고 혁신적인 의약품을 위해 미국에서 개념 증명 연구를 하고, 한국에서 마케팅을 위한 현지 파트너를 찾습니다.
한국의 생명공학이 제약 분야에서 획기적인 발견과 발명을 할 수 있도록 하기 위해 무엇을 할 수 있을까?
한국은 두 가지 접근법을 취해야 한다. 첫 번째는 국내 과학기술의 육성 및 이용이라는 사내 접근이다. 한국의 과학, 창업, 벤처기업의 비교적 작은 규모의 짧은 역사를 고려할 때, 나는 한국의 벤처기업이 비교적 잘 해낸 것으로 생각한다. ViroMed는 좋은 예이다. 주위를 둘러보면, 나는 한국 대학들의 엄청난 잠재력을 본다. 나는 한국 정부가 적절한 법적, 재정적 인프라를 제공함으로써 신생 기업들을 더욱 적극적으로 홍보하기를 바란다. 창업에는 두 가지 유형이 있다. 즉, 대학 교수진과 그 동료 또는 자신의 사업을 차리기 위해 직장을 떠난 사람들에 의해 설립되었다. 나는 전자의 경우에서 큰 잠재력을 본다. 유일한 병목현상은 대학의 전통적 역할에서 어떠한 변화도 거부하는 보수적인 학문문화이다.
두 번째 접근법은 미국이나 일본, 유럽 등 다른 나라에서 개발된 기술의 사용이다. 한국의 연구개발 예산 규모는 작다. 설상가상으로, 예산 집행은 관료들과 아마추어 학자들에 의해 잘 관리되지 않는다. 따라서, 한국에서 진정 의미 있는 발견과 발명의 가능성은 희박하다.하지만 한국 과학자들은 해외에서 개발된 초기 단계의 기술을 유형 제품으로 전환하는 데 아주 능하다. 이 접근법은 이미 시행되고 있다. 많은 사람들은 최근 코오롱생명과학과 신라의 두 유전자 약품이 실제로 외국산 제품이라는 사실을 모르고 있다. 코오롱의 균질 세포/황금 치료제인 인보사는 원래 미국의 한 한국계 과학자가 설립한 티슈게인이 개발했으며, 신라는 그들의 미국 내 백신 바이러스였다. 코오롱과 실레겐은 이들 제품을 국내 금융시장에 도입해 국내 증시로부터 자금을 확보해 3단계 시험을 진행했다. 나는 오랫동안 이 접근법을 지지해 왔지만 한국의 애국적 또는 민족주의적 문화가 이것을 용이하게 한다.
2025년까지 유전자 치료로 가장 많은 수입을 올린 생명공학 회사가 되기 위해 노력하고 있습니다. 이 목표가 얼마나 현실적이라고 생각하세요?
우리는 2023년까지 이것을 달성하기를 희망합니다. 심지어 2025년 목표보다 더 빨리요. 이는 VM202가 언제 시장에 진입할 것인지에 따라 달라집니다. 작년에 우리는 외부 컨설팅 회사에 PDPN의 약가 및 시장 규모를 요청했는데, PDPN은 질병의 의학적 필요성과 심각성을 감안할 때 VM202가 5년 후부터 100억 달러 이상의 수익을 창출할 수 있다고 제안했습니다. 수입은 몇 년 후에 바닥이 날 때까지 계속 증가할 것이다. 이것은 미국 시장의 PDPN 표시만을 위한 것이다. 단순히 가정에 불과하지만, 다른 독립적인 출처의 추정치와 일치한다. 예를 들어, 런던에 기반을 둔 GlobalData도 2026년까지 세계 PDPN 시장의 45% 이상이 VM202에 의해 캡처될 수 있다고 보고했습니다.
3단계에 23명의 후보자가 있다. 그들 대부분은 희귀 유전질환과 시장에 제한된 암환자를 치료한다. 그러므로, 나는 세계에서 가장 잘 팔리는 유전자 약을 갖는 내 목표에 만족한다.










RECENT COMMENT