검색결과 리스트
글
http://news.mt.co.kr/mtview.php?no=2019022015191642475
======================================================================
대웅제약 '나보타'이어 SK바이오팜, 한미약품등 토종신약들 연내 FDA 허가 기대
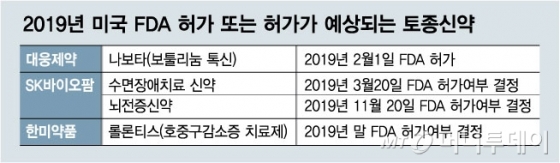
 3000 -1.5%)의 보툴리늄톡신 제재 ‘나보타’는 미 식품의약국(FDA)의 허가승인을 받아 시판을 눈앞에 뒀다. 뿐만 아니라 SK바이오팜의 수면장애·뇌전증 신약, 한미약품 (490,000원 3000 -1.5%)의 보툴리늄톡신 제재 ‘나보타’는 미 식품의약국(FDA)의 허가승인을 받아 시판을 눈앞에 뒀다. 뿐만 아니라 SK바이오팜의 수면장애·뇌전증 신약, 한미약품 (490,000원  4500 0.9%)의 호중구감소증 치료제 등 다수의 토종신약이 FDA 허가승인을 기다리고 있다. 4500 0.9%)의 호중구감소증 치료제 등 다수의 토종신약이 FDA 허가승인을 기다리고 있다.국내 제약·바이오기업들이 미국시장 진출에 사활을 거는 이유는 세계 최대 의약품시장인 데다 글로벌 기술표준을 선도하는 곳이기 때문이다. 진입장벽이 높은 미국 시장에서 성공은 곧 세계 시장에서 성공을 의미하는 셈이다. ◇SK바이오팜 등 토종신약 3개, 연내 FDA 허가 전망=연내 FDA의 판매 허가승인이 기대되는 토종신약은 SK바이오팜의 수면장애 신약과 뇌전증 신약, 그리고 한미약품의 호중구감소증 치료제다. SK바이오팜은 2017년말 수면장애 신약 ‘솔리암페톨’의 판매 허가승인 신청서를 FDA에 제출했다. 솔리암페톨은 기면증 또는 폐쇄성수면무호흡증을 동반한 성인 환자의 각성상태를 개선하고 주간 졸림증을 완화하는 용도로 사용되는 약물로 2011년 미국 재즈에 기술수출했다. FDA는 오는 3월20일까지 승인 여부를 결정, 발표할 예정이다. SK바이오팜이 임상1상부터 3상까지 모두 자체적으로 진행한 뇌전증 신약 ‘세노바메이트’도 연내 허가 가능성이 높다. ‘세노바메이트’는 지난해 4월 글로벌 임상3상이 완료됐으며 지난해말 FDA에 허가승인 신청서를 제출했다. ‘세노바메이트’의 허가승인 여부는 오는 11월 발표된다. 한미약품의 장기지속형 호중구감소증 치료제 ‘롤론티스’도 연내 FDA 허가승인을 받을 것으로 기대된다. ‘롤론티스’는 한미약품의 체내 바이오의약품 약효 지속시간을 늘려주는 독자기술인 ‘랩스커버리’를 적용, 기존 약들보다 복용 편의성을 강화한 것이 특징이다. FDA 검토절차가 순조로울 경우 빠르면 연말쯤 허가가 나올 것으로 전망된다. ◇바이로메드 등 토종신약 허가신청도 줄줄이=토종신약들의 FDA 허가승인 신청도 줄줄이 이어질 전망이다. 바이로메드 (290,600원  2300 0.8%)는 당뇨병성 신경병증 유전자 치료제(VM202-DPN) 임상에서 마지막 환자 투약까지 마치고 임상결과를 기다리고 있다. 바이로메드는 결과가 나오는 대로 FDA에 판매 허가승인 신청서를 제출할 예정이다. 2300 0.8%)는 당뇨병성 신경병증 유전자 치료제(VM202-DPN) 임상에서 마지막 환자 투약까지 마치고 임상결과를 기다리고 있다. 바이로메드는 결과가 나오는 대로 FDA에 판매 허가승인 신청서를 제출할 예정이다. 바이로메드는 성공적인 미국시장 진출을 위해 지난해 4월부터 현지 신경학회, 임상내분비학회, 심혈관학회, 국제통증연구협회, 가정의학학회 전문의 등을 대상으로 ‘KOL(Key Opinion Leader) 미팅’도 진행 중이다. KOL 미팅은 신약 출시 전 현지 의사들과 만나 제품을 소개하고 전문가들의 니즈를 파악하는 것을 말한다. 통상 제약·바이오기업이 KOL 미팅을 진행한다는 것은 ‘신약 출시’ 가능성이 그만큼 높아졌다는 뜻이다. 한미약품의 혁신 항암신약 ‘포지오티닙’도 FDA 허가승인 신청을 준비 중이다. 한미약품과 파트너사 스펙트럼은 올 하반기 ‘포지오티닙’에 대한 임상2상 중간결과를 발표하고 그 결과를 토대로 연내 FDA에 허가승인 신청서를 접수한다는 계획이다. 미국도 한국과 마찬가지로 항암신약 등 기존 치료제가 없는 분야에서는 임상2상 결과만으로도 허가승인 신청을 할 수 있다. 한 제약사 관계자는 “최근 미국시장에 도전장을 내미는 품목이 복제약이나 개량신약뿐만 아니라 혁신신약으로 확대된다”며 “‘나보타’가 올해 그 시작을 알렸고 연내 3개 제품이 더 허가될 것으로 보인다”고 말했다. 이어 “단순히 진출에서 그치는 것이 아니라 상업적으로 성공할 날도 멀지 않았다”고 덧붙였다. |


RECENT COMMENT